
(14分)A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。
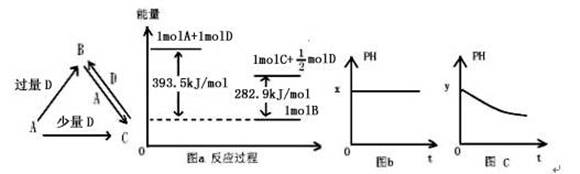
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 。
②反应B+A→C的离子方程式为 。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其PH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为 (填化学式),此时图b中x 7(填“﹥”“﹤”“﹦”)
②若图c符合事实,已知图c中y﹤7,则其PH变化的原因是 (用离子方程式表示)
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式:
(1)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O (2分)
(2) ①Al(OH)3 (2分) ②3AlO2-+Al3++6H2O=4Al(OH)3↓ (2分)
(3)①CO2 (2分) > (2分) ②2HSO3-+O2=2SO42-+2H+ (2分)
(4)2C(s)+O2(g)=2CO(g) ΔH=-221.2 kJ·mol-1 (2分)
【解析】(1)当强酸D的量不同时,能生成不同的化合物,所以根据图中转化关系可知,A应该是变价的金属,常见的应该是是铁,则D就是硝酸,因此C+D→B的离子方程式为
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。
(2)A盐和强碱反应生成C,而C能继续和强碱反应生成另外一种盐,说明C应该是氢氧化铝,所以A氯化铝,D是氢氧化钠,B是偏氯酸钠。氯化铝水解显酸性,偏氯酸钠水解显碱性,二者相互促进生成氢氧化铝沉淀,方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓。
(3)若A为强碱,D为气态氧化物,则符合条件的是CO2和SO2,由于亚硫酸氢钠不稳定,易被氧化生成磷酸氢钠,因而溶液的酸性增大,而碳酸氢钠的pH是不变的,所以符合图b是CO2,碳酸氢钠的水解程度大于电离程度,溶液显碱性;符合图c的是SO2,亚磷酸氢钠被氧化的方程式为2HSO3-+O2=2SO42-+2H+。
(4)若A为非金属单质,D是空气的主要成分之一,则A是碳,D是氧气,B是CO2,C是CO。根据图像可知①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1 ,②CO(g)+1/2O2(g)=CO2(g) ΔH=-282.9 kJ·mol-1。所以根据盖斯定律可知(①-②)×2即得到2C(s)+O2(g)=2CO(g),所以反应热ΔH=(-393.5 kJ·mol-1+282.9 kJ·mol-1)×2=-221.2 kJ·mol-1。


科目:高中化学 来源: 题型:
 A、B、C、D均为常见物质,相互之间的关系如图所示.“-”表示两种物质间能发生反应,“→”表示物质间的转化关系,部分反应物或生成物以及反应条件已略去).
A、B、C、D均为常见物质,相互之间的关系如图所示.“-”表示两种物质间能发生反应,“→”表示物质间的转化关系,部分反应物或生成物以及反应条件已略去).

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):试回答:
A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):试回答:

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3 2NH3
2NH3

| 4(m-n) |
| 5 |
| 4(m-n) |
| 5 |
| 4n+m |
| 5 |
| 4n+m |
| 5 |
| 4m+3n |
| 5 |
| 4m+3n |
| 5 |
| m-3n |
| 5 |
| m-3n |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
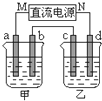 如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )
如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )| A、甲、乙溶液的pH均减小 | B、电极b上生成气体的体积约为2.8L(标准状况下) | C、电极d上发生的反应为:2H2O+2e-?H2↑+2OH- | D、欲使甲中的溶液恢复至原来的浓度,可加入24.5g的Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .甲和丙可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M.1mol乙与足量丙可化合生成Z,所得的Z与热水反应的产物W需用12mol KOH才能完全中和.乙在足量丁中燃烧生成化合物N,N和水反应生成W和D元素的气态氢化物.试回答下列问题:
.甲和丙可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M.1mol乙与足量丙可化合生成Z,所得的Z与热水反应的产物W需用12mol KOH才能完全中和.乙在足量丁中燃烧生成化合物N,N和水反应生成W和D元素的气态氢化物.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com