
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A. | T1>T2,且a>0 | |
| B. | 当温度为T2、反应进行到40 min时,x>0.15 | |
| C. | 温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol | |
| D. | 温度为T1时,达平衡时CH4 的转化率大于NO2的转化率 |
分析 A.温度升高,反应速率加快,甲烷剩余量增多,说明反应向左进行,正反应放热;
B.温度升高,反应速率加快,当温度为T1、反应进行到40 min时已达平衡状态,温度为T2时反应也应该达到平衡状态;
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,可等效为在另一个相同的容器中建立一个和原平衡相同的平衡状态,再压缩到一个容器中,即为增大压强,平衡逆向移动;
D.温度为T1时,达平衡时n(CH4 )=0.1mol,则分别消耗CH4、NO2的物质的量为0.4mol、0.8mol.
解答 解:A.温度升高,反应速率加快,因此T2>T1,甲烷剩余量增多,说明反应向左进行,正反应放热,所以a<0,故A错误;
B.当温度为T2,温度较高,反应速率较大,达到平衡时用时较少,则反应进行到40 min时,反应达到平衡状态,x=0.15,故B错误;
C.温度为T2时,原平衡时消耗n(CH4)=0.5mol-0.15mol=0.15mol,则反应生成0.35molN2,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,平衡逆向移动,重新达到平衡时,n(N2)小于原平衡n(N2)的2倍,故C错误;
D.温度为T1时,达平衡时n(CH4 )=0.1mol,则分别消耗CH4、NO2的物质的量为0.4mol、0.8mol,转化率分别为$\frac{0.4}{0.5}$=0.8、$\frac{0.8}{1.2}$=0.67,可知达平衡时CH4 的转化率大于NO2的转化率,故D正确.
故选D.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,注意把握温度对平衡移动的影响以及转化率的计算,难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:实验题
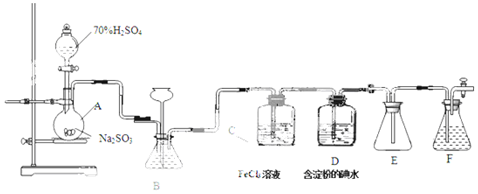
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用菜籽油浸泡花椒制得花椒油的过程主要利用其物理性质 | |
| B. | 卤水点豆腐是Mg2+、Ca2+等使蛋白质胶体发生聚沉的过程 | |
| C. | 热的纯碱溶液可用于除去金属表面的矿物油(如机油、润滑油等) | |
| D. | 亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的简单阴离子半径一定大于Z的简单阳离子半径 | |
| B. | 最简单氢化物的稳定性:X-定强于Y | |
| C. | Y单质分子的电子式-定为 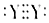 | |
| D. | X、W形成化合物的水溶液必须保存在带玻璃塞的细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①为放热反应 | B. | 增大反应①的压强,H2转化率提高 | ||
| C. | 反应②使用催化剂,△H2不变 | D. | △H3=-58 KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
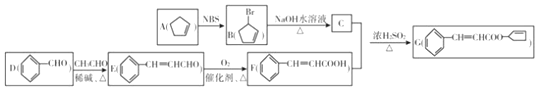
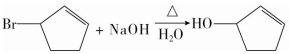 ,其反应类型为取代反应(或水解反应).
,其反应类型为取代反应(或水解反应).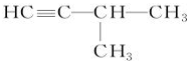 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积恒定为2L的密闭容器内通入0.8mol H2和一定量的I2(g),一定温度下发生反应:H2 (g)+I2(g)═2HI(g),反应中各物质的浓度随时间的变化情况如图所示,其中I2(g)的浓度变化曲线前半部分已略去.
在容积恒定为2L的密闭容器内通入0.8mol H2和一定量的I2(g),一定温度下发生反应:H2 (g)+I2(g)═2HI(g),反应中各物质的浓度随时间的变化情况如图所示,其中I2(g)的浓度变化曲线前半部分已略去.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g石墨中含有C-C键的个数为3NA | |
| B. | 7.8g Na2O2晶体中含有阴阳离子总数为0.4NA | |
| C. | 1 mol SiO2晶体中含有4NASi-O键 | |
| D. | 1.4 g乙烯(C2H4)和丙烯(C3H6)的混合物中含碳氢键数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验目的 | |
| A | 向待测液中滴加盐酸和稀硝酸 | 产生白色沉淀 | 检验待测液中是否含有Ag+ |
| B | 将含有少量CO2的CO气体緩缓通过足量的 过氧化钠粉末 | 淡黄色粉末变白 | 除去CO2,提纯CO |
| C | 在Na2S溶液中滴加新制氯水 | 产生浅黄色沉淀 | 证明氯的非金属性比硫的强 |
| D | 在Ag2S浊液中滴加NaCl溶液 | 产生白色沉淀 | 比较Ag2S和AgCl的溶解度大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com