
| A. | 2:1 | B. | 1:1 | C. | 1:2 | D. | 3:2 |
分析 第一份中发生反应NaHCO3+HCl═NaCl+H2O+CO2↑,第二份中加热发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,再加入盐酸,发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,两份粉末中发生反应最终都生成氯化钠,令碳酸氢钠的物质的量为1mol,结合钠元素、氯元素守恒来解答.
解答 解:第一份中发生反应NaHCO3+HCl═NaCl+H2O+CO2↑,第二份中加热发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,再加入盐酸,发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,两份粉末中发生反应最终都生成氯化钠,令碳酸氢钠的物质的量为1mol,由钠元素守恒可知n(NaHCO3)=n(NaCl)=1mol,根据氯元素守恒可知n(NaCl)=n(HCl)=1mol,故反应后两份粉末中实际消耗的HCl的物质的量之比为1mol:1mol=1:1,质量之比是1:1,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及元素守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.5 | 90.0 |
| ② | ? | 0.5 | 2.5 | 36.0 |
| ③ | 碳粉质量的影响 | 0.2 | ? | 90.0 |
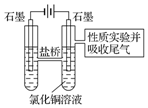
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于漂白纸浆 | B. | SiO2是良好的半导体材料 | ||
| C. | Na2O2可用作潜水艇O2来源 | D. | Cl2可用于消毒和制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②HNO3 | ③NaOH ④KOH | ⑤Na2SO4 ⑥K2SO4 | ⑦SO2 ⑧SO3 | ⑨NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑦⑧ | D. | ②③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+H2SO4═CO2↑+H2O+Na2SO4 | B. | CO2+2NaOH═Na2CO3+H2O | ||
| C. | CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C | D. | CO2+Na2O=Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
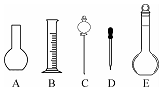 某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.
某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com