
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$C+NO2 | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
分析 A.发生氧化还原反应生成硝酸铁、S、NO和水;
B.反应生成碳酸钠、一水合氨;
C.反应生成氮气和二氧化碳;
D.反应生成醋酸钙、水、二氧化碳.
解答 解:A.硫化亚铁溶于稀硝酸中的离子反应为NO3-+FeS+4H+═Fe3++NO↑+S+2H2O,故A错误;
B.NH4HCO3溶于过量的NaOH溶液中的离子反应为NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O,故B错误;
C.用催化法处理汽车尾气中的CO和NO的反应为2CO+2NO$\stackrel{催化剂}{→}$2CO2+N2,故C错误;
D.大理石溶于醋酸中的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:选择题
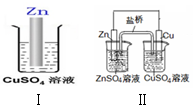
| A. | Ⅱ中盐桥中的Cl-移向ZnSO4溶液 | |
| B. | Ⅰ、Ⅱ的反应原理均是Zn+Cu2+=Zn2++Cu | |
| C. | Ⅰ、Ⅱ中均有电子转移,均是把化学能转化成电能利用 | |
| D. | 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
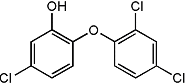 三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )| A. | 物质的分子式为C12H7Cl3O2 | |
| B. | 该物质苯环上的一溴取代物有6种 | |
| C. | 该物质中含有四种官能团 | |
| D. | 该物质中所有原子都可能处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
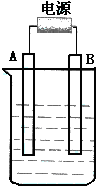 如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:
如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(B+)>c(H+)>c(OH-) | B. | c(B+)>c(A-)>c(OH-)>c(H+) | ||
| C. | c(B+)+c (H+)>c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
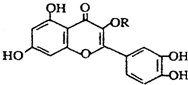
| A. | 若R为甲基则该物质的分子式可以表示为C16H10O7 | |
| B. | 分子中有三个苯环 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与7molBr2完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO2)2溶液中加入过量NaOH溶液Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 酸性条件下KIO3溶液与KI溶液反应IO${\;}_{3}^{-}$+5I-+3H2O═3I2+6OH- | |
| C. | AlCl3溶液中加入少量Na 2Al3++6Na+6H2O═2Al(OH)3↓+6Na++3H2↑ | |
| D. | FeBr2溶液中通入少量Cl2 2Fe2++4Br+3Cl2→2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
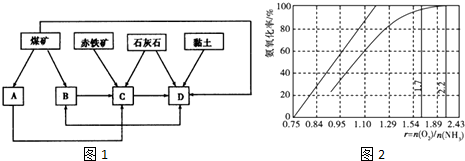
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
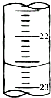 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com