
【题目】一定温度下,将1 mol A和1 mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)![]() xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是

A.反应方程式中的x=1
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量物质C
D.t1~t3间该反应的平衡常数均为4
【答案】D
【解析】
试题分析:A、根据图像可知,在t2时刻,平衡不移动,但C的浓度变大,说明在在t2时刻改变的条件是缩小容器的体积,且该反应前后气体体积不变,所以可知x=2,所以化学方程式为:A(g)+B(g)![]() 2C(g)+D(s),根据方程式中的计量关系可知,在t1时刻达到平衡,生成0.5mol/LC,则A、B平衡的浓度均为0.25mol/L,所以平衡常数K=0.52/(0.25×0.25)=4,而t1~t3间温度没变,所以平衡常数不变,A错误;B、t2时刻改变的条件是缩小容器的体积,B错误;C、t3时刻C的浓度增大,不可能是移去少量物质C,C错误;D、根据以上分析可知K=4,D正确,答案选D。
2C(g)+D(s),根据方程式中的计量关系可知,在t1时刻达到平衡,生成0.5mol/LC,则A、B平衡的浓度均为0.25mol/L,所以平衡常数K=0.52/(0.25×0.25)=4,而t1~t3间温度没变,所以平衡常数不变,A错误;B、t2时刻改变的条件是缩小容器的体积,B错误;C、t3时刻C的浓度增大,不可能是移去少量物质C,C错误;D、根据以上分析可知K=4,D正确,答案选D。


科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. Na2O2吸收CO2产生O2 ,可用作呼吸面具供氧剂
B. ClO2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,能导电的是 ,属于电解质的是 (填序号)。
①氨气、②氨水、③NH3·H2O、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石
(2)将等物质的量的①Na、②Na2O、③Na2O2、④NaOH投入相同质量的水中,所得溶液浓度由大到小的顺序为 。如果将等物质的量换成等质量则 。(填序号)
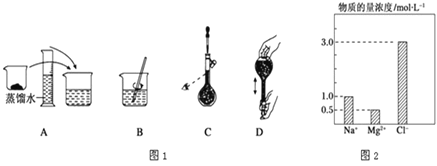
(3)如图表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是___________,这样操作所配制的溶液比要求的浓度要___________ (填“偏高”、“偏低”、“不影响”)。配制应称取___________gNaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.2 mol B. 1.6 mol C. 2.4 mol D. 2.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应中,平衡常数与反应进行的限度关系正确的是( )
A.K越大,反应程度越大 B.K越大,反应程度越小
C.K的大小与反应程度无关 D.升高温度,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.滴定前用待测液润洗锥形瓶
B.容量瓶和滴定管使用前均需要检漏
C.蒸馏完毕时,先关闭冷凝水,再停止加热
D.分液时,下层溶液先从下口放出,上层溶液再从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度(若不存在说明理由) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100ml溶液可能含有Na+、NH4+、Fe3+、 CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)

下列说法不正确的是
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-) ≥0.1mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com