
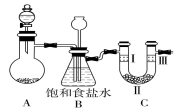
 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
分析 (1)漂粉精固体有效成分为次氯酸钙,具有强的氧化性,能够氧化浓盐酸生成氯气、氯化钙、水;
(2)盐酸易挥发,反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,B中长颈漏斗中液面上升,形成水柱;
(3)验证氯气是否具有漂白性,则先设计湿润的有色物质,再利用干燥剂干燥后与干燥的有色物质混合,注意Ⅱ中干燥剂为固态;
(4)将Cl2通入溴化亚铁溶液中,由于Fe2+的还原性比Br-的还原性强,所以发生反应有以下顺序:Cl2+2Fe2+═2Fe3++2Cl-;Cl2+2Br-═Br2+2Cl-;所以通入氯气的过程中先生成铁离子,后生成溴,溴溶于四氯化碳,颜色为红褐色.Fe3+的不溶于四氯化碳,但溶于水,水溶液是黄色;
(5)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(6)氯气具有强的氧化性,能够氧化亚硫酸钠,F中可改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,可能生成二氧化硫,污染环境.
解答 解:(1)漂粉精固体有效成分为次氯酸钙,次氯酸钙具有强的氧化性,能够氧化浓盐酸生成氯气、氯化钙、水,反应的化学方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
故答案:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
(2)盐酸易挥发,反应制取的氯气中含有氯化氢,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B亦是安全瓶,监测实验进行时C中是否发生堵塞;C中若发生堵塞,生成的氯气使B中压强增大,则B中长颈漏斗下端导管中液面会上升,形成水柱,
故答案为:除氯气中的氯化氢;B中长颈漏斗下端导管中液面会上升,形成水柱;
(3)验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性,只有D符合,
故答案为:D;
(4)A.Fe2+、Br-的还原性的强弱为:Fe2+>Br-,当一种氧化剂遇到两种还原性不同的还原剂时先与还原性强的还原剂发生反应,因此通入氯气后先发生Cl2+2Fe2+═2Fe3++2Cl-;只有当Fe2+、反应完成后,再与Br-反应,而且生成的Fe3+不再与溶液中的其他物质发生反应,因此从反应开始自始至终溶液中都有Fe3+,溶液始终为黄色,故A正确;
B.根据对A的分析可知水层为黄色,故B错误;
C.根据Fe2+、Br-的还原性的强弱为:Fe2+>Br-,当一种氧化剂遇到两种还原性不同的还原剂时先与还原性强的还原剂发生反应,因此通入氯气后先发生Cl2+2Fe2+═2Fe3++2Cl-;只有当Fe2+、反应完成后,再与Br-反应Cl2+2Br-═Br2+2Cl-;因此刚开始时四氯化碳层是无色的,当有溴生成时四氯化碳层才变为红棕色.故C错误;
D.根据对C的分析,当有溴产生时四氯化碳层就变为红棕色,故D错误;
故答案为:A;
(5)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质,故工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,
故答案为:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(6)氯气与亚硫酸钠反应生成硫酸钠和盐酸,离子方程式:Cl2+SO32-+H2O=SO42-+2H++Cl-,改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,反应的离子反应为:4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O,可能生成二氧化硫,污染环境,则不能用NaHSO3溶液吸收尾气,
故答案为:Cl2+SO32-+H2O=SO42-+2H++Cl-;否.
点评 本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式、离子方程式的书写,充分考查了学生的分析、理解能力及化学实验能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 当x≤n时,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 当x≥$\frac{3n}{2}$时,反应的离子方程式为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 当n≤x≤$\frac{3n}{2}$时,反应中转移电子的物质的量n(e-)为2nmol≤n(e-)≤3nmol | |
| D. | 当n<x<$\frac{3n}{2}$时,溶液中Fe3+、Cl-、I2的物质的量之比为2(x-n):x:n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) | B. | c(H+)+c(Ba2+)=c(CH3COO-)+c(OH-) | ||
| C. | c(OH-)═c(H+)+c(CH3COO-) | D. | 2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | Y的阳离子半径比W的阴离子半径小 | |
| C. | X、Z、W最高价氧化物对应水化物酸性的强弱顺序为X<Z<W | |
| D. | 室温下,含Y元素的盐形成的水溶液其pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
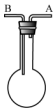 利用如图装置收集以下气体:①H2、②Cl2、③CH4、④HCl、⑤HBr
利用如图装置收集以下气体:①H2、②Cl2、③CH4、④HCl、⑤HBr查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H6 | C5H12 | C8H18 |
| A. | C13H28 | B. | C17H36 | C. | C26H54 | D. | C53H108 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下.22.4LH2S和SO2的混合气体中含有的分子总数为NA | |
| B. | 1L1mol•L-1FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA | |
| C. | 高温下.16.8gFe与足量的水蒸气完全反应失去的电子数为0.8NA | |
| D. | 28.6gNa2CO3•10H2O溶于水配成1L溶液.该溶液中阴离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com