
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为
A.300 mL B.400 mL C.450 mL D.500 mL
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学物质的分离和提纯(解析版) 题型:选择题
下列实验能达到预期目的的是
A.向煮沸的1 mol·L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
B.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
C.称取19.0 g SnCl2,用100 mL蒸馏水溶解,配制1.0 mol·L-1 SnCl2溶液
D.用氢氧化铜粉末检测尿糖
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氯、溴、碘及其化合物主要性质(解析版) 题型:选择题
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl—→2KCl+5Cl2↑+2MnCl2+8H2O
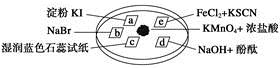
对实验现象的“解释或结论”正确的是
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氮气、氧化物及硝酸(解析版) 题型:选择题
2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中c(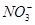 )=0.80 mol·L-1
)=0.80 mol·L-1
B.反应后的溶液最多还能溶解1.82 g Fe
C.反应前HNO3溶液的浓度为1.0 mol·L-1
D.1.12 L气体是NO、NO2的混合气体
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氨及铵盐(解析版) 题型:选择题
下列叙述中正确的是
A.实验室制取氨气的发生装置与用高锰酸钾制取氧气的装置相同
B.并不是所有的铵盐都能与烧碱共热生成氨气
C.除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO
D.CO2、NO2、P2O5均与水反应生成酸为酸性氧化物
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原概念(解析版) 题型:填空题
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氧化钠辖液电解实验,如图所示。
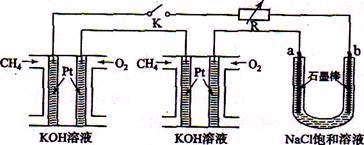
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通如量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×l04C · mol-1列式计算),最多能产生的氯气体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原概念(解析版) 题型:选择题
将0.195g锌粉加入到20.0 mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
A.M B.M2+ C.M3+ D.MO2+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原反应方程式的配平及相关计算(解析版) 题型:选择题
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选
(2)焙烧,主要反应:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣)
(3)制粗铜,在1200 ℃发生的主要反应:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑
(4)电解精炼
下列说法正确的是
A.上述焙烧过程的尾气均可直接排空
B.由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2
C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,作氧化剂的只有Cu2O
D.电解精炼时,粗铜应与外电源负极相连
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(非金属)(解析版) 题型:选择题
下列化学实验事实及其结论都正确的是。
选项 | 实验事实 | 结论 |
A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化性 |
D | 将SO2通入溴水中,酸性高锰酸钾溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com