
【题目】某气态烃A的产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如图所示:
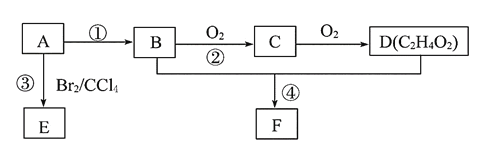
(1)A的结构式为______,D中官能团的名称为_____。
(2)反应③的化学方程式为___________。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2~3次。该反应的化学方程式为___________。

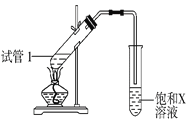
(4)B、D在浓硫酸的作用下实现反应④,实验装置如图所示,试管1中装入药品后加热。图中X的化学式为______。试管1中反应的化学方程式为__________。
【答案】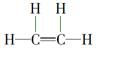 羧基 CH2=CH2+Br2
羧基 CH2=CH2+Br2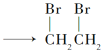 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O Na2CO3 CH3COOH+CH3CH2OH
2CH3CHO+2H2O Na2CO3 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
【解析】
某气态烃A的产量可以用来衡量一个国家的石油化工发展水平,A是乙烯;B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,D是乙酸,则B是乙醇、C是乙醛,F有香味,F是乙酸乙酯。乙烯与Br2的CCl4溶液反应生成1,2-二溴乙烷。
(1)A是乙烯,乙烯的结构式为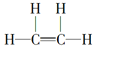 ,D是乙酸,乙酸结构简式是CH3COOH,含有的官能团的名称为羧基。
,D是乙酸,乙酸结构简式是CH3COOH,含有的官能团的名称为羧基。
(2)反应③是乙烯与Br2的CCl4溶液发生加成反应生成1,2-二溴乙烷,反应的化学方程式为 。
。
(3)反应②是乙醇在Cu作催化剂的条件下被氧气氧化为乙醛,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(4)乙酸和乙醇在浓硫酸的作用下发生酯化反应生成乙酸乙酯,用饱和碳酸钠溶液收集乙酸乙酯,图中X的化学式为Na2CO3。试管1中反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为___。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是___反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是____(填序号)。
A.容器中N2、H2、NH3共存 B.N2、NH3浓度相等
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为____。用氯气和烧碱可进一步反应,制得消毒液,反应的离子方程式为___。
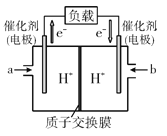
(4)如图是某笔记本电脑使用的甲醇空气燃料电池的结构示意图。放电时甲醇应从__处通入(填“a”或“b”),电池内部H+向__(填“左”或“右”)移动,写出负极的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素对肿瘤细胞的杀伤有独特作用,其结构如图所示,下列有关叙述正确的是( )
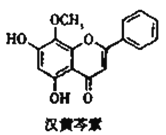
A. 汉黄芩素的分子式为C16H14O5
B. 1mol该物质与NaOH溶液反应,可消耗2molNaOH
C. 1mol该物质与溴水反应,最多消耗1molBr2
D. 该物质可发生取代、加成、缩聚、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与浓硫酸反应,随着硫酸的浓度下降,产生的气体中混有H2,为证实相关分析,化学小组的同学设计了如图所示的实验装置,对反应后的气体(X)取样进行组分分析(遇有气体吸收过程,视为完全吸收)。

(1)A中加入的试剂可能是_________,若高锰酸钾溶液与B 之间不再添加装置,请描述观察到何种现象能表明已达到使用高锰酸钾溶液的目的_______________。
(2)可证实气体 X 中混有较多氢气的实验现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加KSCN溶液,再滴加_____,该过程的现象为________。
(2)步骤②加入过量H2O2的目的是________。
(3)步骤③中反应的离子方程式是_________。
(4)步骤④中一系列处理的操作步骤:过滤、_____、灼烧、冷却、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(_______________)两种物质都不是电解质
(________________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为________________。
②证明有红褐色胶体生成的实验操作是____。
(Ⅱ)反应:
A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水只是氧化剂的是______(填序号),反应B中被氧化的元素名称是________。
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O, 硝酸在该反应中的作用是______ 还原剂与氧化剂的物质的量之比:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2HCHO2H2O)俗称吊白块,在印染、医药以及原子能工业中有广 泛应用。以 Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: 已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在 120℃以上发生分解。
步骤 1:在三颈烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,缓慢通入 SO2,至溶液 pH 约为 4,制得 NaHSO3溶液。
步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在 80~90℃下, 反应约 3h,冷却至室温,抽滤;
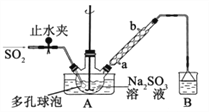
步骤 3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置 B的烧杯中应加入的溶液是_________;冷凝管中冷却水从_______填“a”或“b”)口进水。
(2)A 中多孔球泡的作用是________。
(3)冷凝管中回流的主要物质除 H2O 外还有________(填化学式)。
(4)写出步骤 2 中发生反应的化学方程式________。
(5)步骤 3 中在真空容器中蒸发浓缩的原因是________。
(6)为了测定产品的纯度,准确称取 2.0g 样品,完全溶于水配成 100mL 溶液,取 20.00mL 所配溶液, 加入过量碘完全反应后(已知 I2 不能氧化甲醛,杂质不反应),加入 BaCl2 溶液至沉淀完全,过滤、洗涤、 干燥至恒重得到白色固体 0.466g,则所制得的产品的纯度为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是
A. 电解熔融NaCl制取金属钠的反应中,钠离子被还原,氯离子被氧化
B. 湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e
D. 铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液。由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl36H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是_____________;
(2)试剂A是______;
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是______;
a. 检验Cl2的存在 b. 检验Fe3+的存在 c. 检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是______(填字母)。
a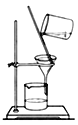 b
b c
c d
d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com