
【题目】下列说法错误的是( )
A. ![]() 溶液中:
溶液中:![]()
B. ![]() 溶液中:
溶液中:![]()
C. 配制![]() 溶液,应加少量盐酸
溶液,应加少量盐酸
D. 将![]() 溶液蒸干,灼烧得
溶液蒸干,灼烧得![]()
【答案】D
【解析】
A、在醋酸溶液中存在物料守恒:c(CH3COO-)+c(CH3COOH)=0.1mol·L-1,故A说法正确;
B、在硫化钠溶液中存在质子守恒,即c(OH-)=c(H+)+c(HS-)+2c(H2S),故B说法正确;
C、FeCl3属于强酸弱碱盐,Fe3+发生水解:Fe3++3H2O![]() Fe(OH)3+3H+,加入少量的盐酸,c(H+)增大,抑制Fe3+水解,故C说法正确;
Fe(OH)3+3H+,加入少量的盐酸,c(H+)增大,抑制Fe3+水解,故C说法正确;
D、Al2(SO4)3属于强酸弱碱盐,Al2(SO4)3溶液中存在Al2(SO4)3+6H2O![]() 2Al(OH)3+3H2SO4,盐类水解是吸热过程,加热促进水解,但硫酸为难挥发性酸,因此硫酸铝溶液蒸干仍为硫酸铝,故D说法错误。
2Al(OH)3+3H2SO4,盐类水解是吸热过程,加热促进水解,但硫酸为难挥发性酸,因此硫酸铝溶液蒸干仍为硫酸铝,故D说法错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是 ( )
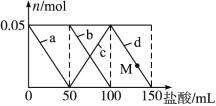
A. a曲线表示的离子方程式为:AlO2-+H++H2O ==Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9 g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1溴丁烷的反应如下:NaBr+H2SO4=HBr+NaHSO4①;R—OH+HBr→R—Br+H2O②。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
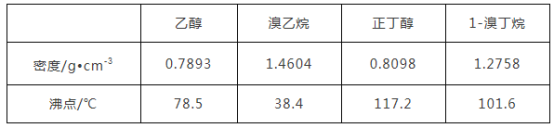
请回答下列问题:
(1)在溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
A.圆底烧瓶 B.量筒 C.锥形瓶 D.漏斗
(2)溴代烃的水溶性____(填“大于”“等于”或“小于”)相应的醇,其原因是________________。
(3)将1溴丁烷粗产品置于分液漏斗中,加水振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
A.NaI B.NaOH C.NaHSO3 D.KCl
(6)在制备溴乙烷时,采用边反应边蒸馏产物的方法,其有利于________;但在制备1溴丁烷时却不能边反应边蒸馏,其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
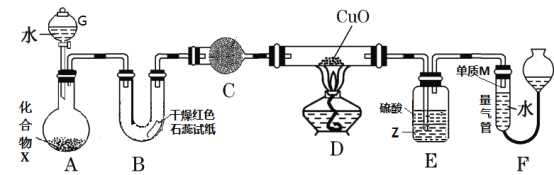
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中金属元素和非金属元素质量比为69:14,写出X与水反应的化学方程式:_________________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D
中固体颜色发生变化)________________________________________ 。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:_________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济成为人们一种新的生活理念。二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合所学知识回答:
(1)①用CO2催化加氢可制取乙烯:CO2(g)+3H2(g)![]() 1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。
1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。
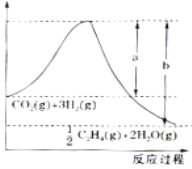
已知:几种化学键的键能如下表所示,实验测得上述反应的△H=-152kJmol﹣1,则表中的x=___________。
化学键 | C=O | H-H | C=C | C-H | H-O |
键能/kJmol﹣1 | 803 | 436 | x | 414 | 464 |
② 以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如下图所示。则N极上的电极反应式为____________;该电解池中所发生的总反应的化学方程式为__________。
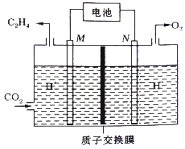
(2)用CO2催化加氢可以制取乙醚的反应如下:2CO2(g)+6H2(g)![]() CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。
CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJmol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。
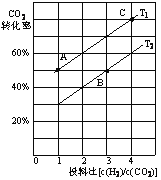
①T1_______T2(填“<”、“=”或“>”),判断理由是__________________________。
②T1温度下,将6 mol CO2和12mol H2充入2 L的密闭容器中,经过5 min反应达到平衡,则0~ 5 min内的平均反应速率υ(CH3OCH3)=______。
③一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是______(填标号)。
A.逆反应速率先增大后减小 B.容器中 c(H2)/c(CO2)的比值减小
C.H2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是( )
A. T1时0~10 min NO2的平均反应速率为0.15 mol·L-1·min -1
B. T2时CH4的平衡转化率为70.0%
C. 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种应用较广的催化剂,易水解。以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线如下:
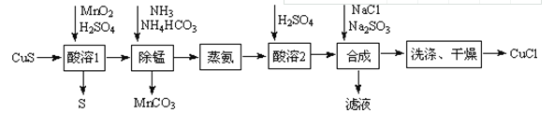
(1)酸溶1步骤中加入MnO2的作用是______。
(2)除锰步骤Mn2+转化为MnCO3沉淀,该反应的离子方程式为______。溶液中CuSO4转变为Cu(NH3)4CO3留在溶液中。
(3)蒸氨步骤会得到CuO固体,该步骤在减压条件下进行的原因是______。
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生SO2气体,除可能与酸溶时硫酸过量有关,还可能的原因是______。
(5)有工艺将合成步骤的NaCl与Na2SO3换为NH4Cl和(NH4)2SO3,则可获得一种可作为氮肥的副产品,其化学式为_____。
(6)洗涤步骤先用______洗,再用无水乙醇洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同,浓度未知的Na2CO3和HCl溶液,将它们互相滴加,产生的气体在相同的温度和压强下的体积比为1:3,则Na2CO3和HCl溶液的浓度之比为( )
A. 5:6 B. 2:5 C. 3:4 D. 5:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com