
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Na+和SO42﹣的离子个数比为( )
A.1: 2
B.1:4
C.3:4
D.3:2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
①CaBr2 ②NH4Cl ③H2O2 ④Na2O2 ⑤ HClO ⑥Al
(1)只含有离子键的是(用序号回答,下同)___________________________,并用电子式表示该化合物的形成过程_________________________________________;
(2)含有共价键的离子化合物是__________,并写出其中含有非极性键化合物的电子式___________;
(3)属于共价化合物的是_________________,并写出只含有极性键化合物的电子式___________;
(4)熔融状态能导电的化合物是_________________________________;
(5)熔融状态时和固态时,都能导电的是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应Fe3++AgFe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂﹣硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( ) 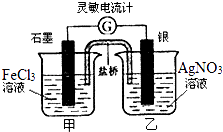
A.在外电路中,电子从石墨电极流向银电极
B.盐桥中的K+移向乙烧杯
C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用下图装置进行实验,试回答:
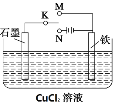
(1)若开始时K接M,则该装置为________(填“原电池”或“电解池”)铁极上的电极反应式为________。
(2)若开始时K接N,则石墨极为______极(填“正”、“负”、“阳” 或“阴”),装置中的总化学方程式为________,铁极上的现象为________,石墨电极的反应现象为________,若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙能调节人体各系统生理功能,利用如图装置测定碳酸钙型补钙剂中钙的含量。已知氨基磺酸(H2NSO3H)俗称固体硫酸,在水溶液中为一元酸,广泛应用于锅炉水垢的清洗。
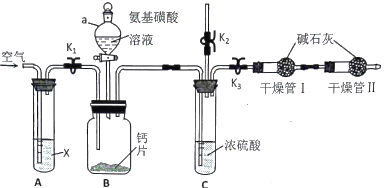
(1)A装置的作用为___________________,仪器a的名称为____________________。
(2)B 装置内发生反应的化学方程式为___________________________________,实验中不用盐酸与钙片反应的原因是_______________________________________。
(3)组装好仪器后,检查装置的气密性,接下来进行的操作是:打开K1、K2,关闭K3,通空气一段时间, ________________(填操作),打开仪器a活塞,滴入氨基磺酸溶液,待B装置中无气泡产生,关闭仪器a活塞。再次打开K1通空气一段时间,第二次通入空气目的是_______________________。如果不使用干燥管Ⅱ,测定结果____________(填“偏高”“偏低”“不变”)。
(4)取某补钙剂样品m克进行测定,测得干燥管Ⅰ在实验前后重量分别为m1克和m2克,则样品中钙的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知NA为阿伏加德罗常数的数值,下列说法正确的是
A. 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B. 一定条件下在密闭容器中2 molSO2与2 molO2充分反应,最终的气体分子数为3NA
C. 将lmolNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D. 4.6g乙醇含有共价键的数目为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如下
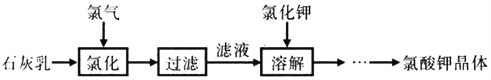
己知:氯化过程主要发生反应6Ca(OH)2+ 6Cl2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
下列说法不正确的是
A. 工业生产氯气的方法是电解饱和食盐水
B. 由制备流程可知:KClO3的溶解度大于Ca(ClO3)2的溶解度
C. 向热的滤液中加入稍过量的氯化钾,溶解后进行冷却,有大量氯酸钾晶体析出
D. 氯化过程需要控制较高温度,其目的是加快反应速率和减少Cl2与Ca(OH)2之间的副反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
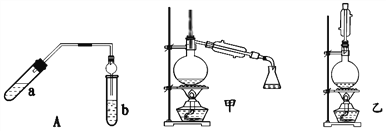
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:_________。
(2)分离出乙酸乙酯层后,经过洗涤杂质;为了干燥乙酸乙酯可选用的干燥剂为______。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
(3)为充分利用反应物,该同学又设计了图中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为更合理的是_________________。理由是:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与用途有关联的是
选项 | 性质 | 用途 |
A | H2能在O2中燃烧并放出大量的热 | H2用作洁净燃料 |
B | 硝酸能与苯发生取代反应 | 苯用作溶剂 |
C | 葡萄糖能与新制Cu(OH)2悬浊液反应 | 葡萄糖可用作甜味剂 |
D | 乙酸能与NaOH溶液反应 | 乙酸可用作调味剂 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com