
【题目】维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
试剂 | pH | ||
初始 | 通入0.01 mol HCl气体 | 加入0.01 mol NaOH固体 | |
i.1 L H2O | 7 | a | 12 |
ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液 | 4.76 | 4.67 | 4.85 |
①a=____________(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:____________。
③试剂ii中微粒浓度关系正确的有____________(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是____________(填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
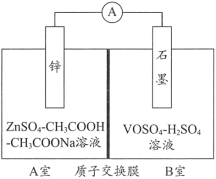
Zn+2VOSO4+2H2SO4![]() ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)____________(填“增大”“减小”或“不变”),结合化学用语说明理由:______。
②充电时,A室中的c(H+)变化缓慢的原因是____________。
【答案】2 试剂ii中同时存在醋酸的电离平衡CH3COOH![]() CH3COO-+H+和醋酸根的水解平衡CH3COO-+H2O
CH3COO-+H+和醋酸根的水解平衡CH3COO-+H2O![]() CH3COOH+OH-,相同条件下,醋酸的电离平衡的限度大于醋酸根的水解平衡限度,当CH3COOH与CH3COO-的初始浓度相等时,溶液中c(H+)>c(OH-) bc bc 减小 放电时,B室发生正极反应:VO2++e-+2H+=V3++H2O;由电极反应可知,转移1 mol e-消耗2 mol H+,同时有1 mol H+通过质子交换膜进入B室,因此总体c(H+)降低 充电时,H+通过质子膜从B室进入A室,A室溶液中的CH3COO-与H+结合成CH3COOH(或“CH3COOH-CH3COONa溶液有缓冲作用”),从而使c(H+)的变化减缓
CH3COOH+OH-,相同条件下,醋酸的电离平衡的限度大于醋酸根的水解平衡限度,当CH3COOH与CH3COO-的初始浓度相等时,溶液中c(H+)>c(OH-) bc bc 减小 放电时,B室发生正极反应:VO2++e-+2H+=V3++H2O;由电极反应可知,转移1 mol e-消耗2 mol H+,同时有1 mol H+通过质子交换膜进入B室,因此总体c(H+)降低 充电时,H+通过质子膜从B室进入A室,A室溶液中的CH3COO-与H+结合成CH3COOH(或“CH3COOH-CH3COONa溶液有缓冲作用”),从而使c(H+)的变化减缓
【解析】
(1)①根据先计算c(H+),然后pH=-lgc(H+)得到a的值;
②结合弱酸的电离平衡及盐的水解平衡分析;
③结合醋酸的电离平衡和醋酸根的水解程度及物料守恒、电荷守恒大小分析;
④根据弱电解质的电离平衡和盐的水解平衡分析;
(2)①放电时装置为原电池,结合VOSO4变为V2(SO4)3分析溶液中c(H+)的变化;
②根据A室中的缓冲溶液的作用分析判断。
(1)①c(HCl)=![]() =0.01 mol/L,则pH=-lgc(H+)=-lg10-2=2;
=0.01 mol/L,则pH=-lgc(H+)=-lg10-2=2;
②将0.10 mol CH3COOH和0.10 mol CH3COONa配制成1 L的溶液,得到0.10 mol/L和0.10 mol/L的混合溶液,在该混合溶液中同时存在醋酸的电离平衡CH3COOH![]() CH3COO-+H+和醋酸根的水解平衡CH3COO-+H2O
CH3COO-+H+和醋酸根的水解平衡CH3COO-+H2O![]() CH3COOH+OH-;在相同条件下,CH3COOH的电离程度大于CH3COO-的水解程度,所以当CH3COOH与CH3COO-的初始浓度相等时,溶液中c(H+)>c(OH-);
CH3COOH+OH-;在相同条件下,CH3COOH的电离程度大于CH3COO-的水解程度,所以当CH3COOH与CH3COO-的初始浓度相等时,溶液中c(H+)>c(OH-);
③a. 在该溶液中存在0.10 mol/L的CH3COOH、CH3COONa的混合溶液,c(Na+)=0.10 mol/L,由于醋酸的电离程度大于醋酸根的水解程度,所以c(CH3COO-)>0.1 mol/L,c(CH3COOH)<0.10 mol/L,因此溶液中微粒浓度c(CH3COO-)>c(Na+)>c(CH3COOH),a错误;
b. 由物料守恒可得①c(CH3COO-)+c(CH3COOH)=2c(Na+);由电荷守恒可得②c(CH3COO-)-+c(OH-)=c(H+)+c(Na+),将②×2-①,整理可得2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-),b正确;
c. 根据物料守恒可知c(CH3COOH)+c(CH3COO-)=2c(Na+)=0.2 mol/L,c正确;
故合理选项是bc;
④a. 向HCl—NaCl的混合溶液中加入酸,溶液中H+浓度增大,pH减小,当加入碱时,溶液中OH-增大,溶液pH增大,a不符合题意;
b. 向Na2CO3—NaHCO3的混合溶液中加入酸,H+与CO32-反应产生HCO3-,溶液中H+浓度几乎不变,当加入碱溶液时,
c. 向NH3·H2O-NH4Cl的混合溶液中加入酸,NH3·H2O与H+反应产生NH4+,溶液中H+浓度几乎不变,当加入碱时,NH4+与OH-反应产生NH3·H2O,也使溶液中H+浓度几乎不变,因此溶液酸碱性对其pH几乎无影响,c符合题意;
d. 向KOH—KCl混合溶液中加入酸,消耗OH-,溶液中OH-浓度降低,碱性减弱;当加入碱时,溶液中溶液中OH-浓度增大,溶液碱性增强,pH发生较大的变化,d不符合题意;
故合理选项是bc;
(2)①放电时该装置为原电池,Zn为负极,失去电子,发生氧化反应,VOSO4电离产生的VO2+得到电子,与溶液中的H+结合反应产生V3+和H2O,电极反应式为:VO2++e-+2H+=V3++H2O;反应消耗H+,使c(H+)降低,由电极反应可知,转移1 mol e-消耗2 mol H+,同时有1 mol H+通过质子交换膜进入B室,因此总体c(H+)降低;
②在充电时,H+通过质子膜从B室进入A室,A室溶液中的CH3COO-与H+结合成CH3COOH(或“CH3COOH-CH3COONa溶液有缓冲作用”),从而使c(H+)的变化减缓。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】铜是人类知道最早的金属之一,也是广泛使用的第一种金属。回答下列问题:
(1)镍白铜(铜镍合金)可用于制作仿银饰品。第二电离能I2(Cu)______________Ⅰ2(Ni)(填“>"或 “<”),其原因为______________。
(2)向[Cu(NH3)2]Cl溶液中通入乙炔(C2H2)气体,可生成红棕色沉淀Cu2C2。
①C2H2分子中![]() 键与
键与![]() 键的数目之比为______________;碳原子的杂化方式为______________。
键的数目之比为______________;碳原子的杂化方式为______________。
②写出与Cu2C2中阴离子C22-互为等电子体的一种分子和一种离子______________。
(3)乙二胺(H2N-CH2CH2-NH2)易与Cu2+形成络合物用于Cu2+的定量测定。
①形成的络合物中提供孤对电子的原子为______________(填元素符号)。
②乙二胺中所含元素的电负性由大到小的顺序为______________;乙二胺在水中溶解度较大的原因为______________。
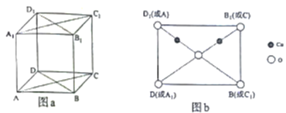
(4)铜与氧构成的某种化合物的立方晶胞如图a所示,图b是沿晶胞对角面取得的截图,晶胞中所有原子均在对角面上。氧原子的配位数为______________,若Cu原子之间最短距离为dpm,阿伏加德罗常数的值为NA,该晶体的密度为______________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某难溶性盐X(仅含三种常见元素)的组成,设计并完成以下实验(流程中部分物质已略去):

已知:气体A和气体B所含元素相同,都是无色无味气体,固体C为纯净物且具有磁性,单质D是目前建筑行业应用最广泛的金属。根据上述信息,回答下列问题:
(1)盐X的化学式为________________。
(2)无水条件下,少量NaH就能与固体C反应并放出大量的热,写出该反应的化学方程式___________________。
(3)将产生的气体A全部被100 mL 0.35 mol·L-1氢氧化钠溶液充分吸收,反应的总离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。

(1)从物质分类的角度,SO2属于____(填“酸性”或“碱性”)氧化物。
①图中D装置可用来验证SO2具有该性质,其中所加入的试剂是________________。
②当向该装置通入SO2时,A中实验现象为_________,用化学用语解释其原因___________。
(2)从元素化合价的角度分析,SO2具有___性。
①当向该装置通入SO2一段时间后,可观察C中实验现象为___,说明SO2具有_____性。
②如验证SO2还具有另一方面的性质,可选择的药品是___,实验现象__________。
A.过氧化氢 B.浓硫酸C.氯水 D.硫化钠溶液
(3)B中的品红溶液现象是___________,证明SO2具有_________性。
(4)多余的SO2一般用氢氧化钠溶液吸收,反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL 4.6mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__________(填仪器名称);需要量取98%浓硫酸____________mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是(___________)。
A. e→a→f→d→c→f→g→b B. e→a→d→f→c→f→g→b
C. e→a→f→d→c→f→b→g D. e→a→d→f→c→f→b→g
(3)下列为配制过程中部分操作的示意图,其中有错误的是____(填序号);

(4)在配制4.6mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏高的是___;
A.未经冷却趁热将溶液注入容量瓶中 B.容量瓶洗涤后,未干燥处理
C.定容时仰视观察液面 D.未洗涤烧杯和玻璃棒
(5)为中和100mL 2.3 mol·L-1KOH溶液后显中性,需要加入________mL 4.6mol·L-1稀硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)上述反应的化学方程式为_____________________
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
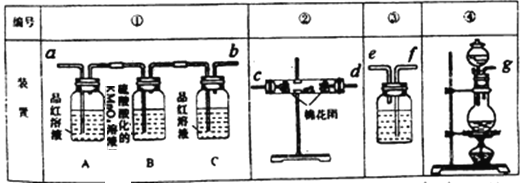
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
_________接__________ ,________接__________,___________ 接_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体(MgSO4·7H2O)的流程如下:

(1)“氧化”的过程目的是在酸性溶液中将Fe2+氧化为易被除去的离子,该过程发生反应的离子方程式是 _______________。
(2)“氧化”后的溶液与氨水反应生成的沉淀的化学式________,其颜色是_______。
(3)“过滤”所得滤液中含有的阳离子主要有______和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列不能用勒夏特列原理解释的是
A. 合成氨时将氨液化分离,可提高原料的利用率
B. H2、I2、HI 混合气体加压后颜色变深
C. 实验室常用排饱和NaCl溶液的方法收集Cl2
D. 新制氯水中,滴加硝酸银溶液,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于氯酸钠(NaClO3)具有吸湿性,不易保存,因此工业上常采用电渗析法将氯酸钠(NaClO3)转化成氯酸钾(KClO3),其工作原理如图所示(a、b两电极均为石墨电极,c、d、e依次为阳离子交换膜、阴离子交换膜、阳离子交换膜),下列法说不正确的是( )

A.a电极连接电源负极
B.左池NaOH溶液出口浓度大于入口浓度
C.该电解池的工作原理实质是电解水
D.制备1molKClO3,a、b两极共产生16.8L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com