
(1)向AlCl3溶液中,滴加少量NaOH溶液,现象是 ,
继续滴加NaOH溶液至过量,现象是 。
(2)钠与水反应的离子方程式为 ,该反应中氧化剂是 ,产生1mol H2时,转移电子的物质的量为 mol。
科目:高中化学 来源: 题型:
(9分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。
| 实验方案(I) | 实验现象(Ⅱ)
| 答案(III) | |
| 实验方案I | 实验现象II | ||
| 1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 加酚酞 | A浮与水面,剧烈反应,放出气体, 熔成—个小球,在水面上无定向移 动,随之消失,溶液变红色。 | 1 |
|
| 2.向新制的H2S饱和溶 液中滴加新制的氯水 | B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 | 2 |
|
| 3.钠与滴有酚酞的冷水反应
| C.反应不十分剧烈,产生的气体 可以在空气中燃烧
| 3 |
|
| 4.镁带与2mol/L的盐酸 反应
| D.剧烈反应,产生的气体可以在 空气中燃烧
| 4 |
|
| 5铝条与2mol/L的盐酸 反应 | E.生成白色絮状沉淀,继而沉淀 消失
| 5 |
|
| 6.向AlCl3溶液中滴加
| F.生成淡黄色沉淀
| 6 |
|
(2)通过以上实验分析了同周期元素的符号 ,从实验结果可以得出的结论是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L
(2)已知下列物质在20 ℃下的Ksp如下:
| 化学式 | AgCl | AgBr | AgI |
| 颜 色 | 白色 | 浅黄色 | 黄色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
①20℃时,上述三种银盐的饱和溶液中,Ag+物质的量浓度由大到小的顺序是:
。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br-)/c(Cl-)= 。
(3)物质的量浓度相同的①氨水、②氯化铵、③碳酸氢铵、④硫酸氢铵、⑤硫酸铵5种溶液中,c(NH)的大小顺序是 (填序号)。
(4)浓度均为0.1mol/L的8种溶液 ① HNO3 ②H2SO4 ③ CH3COOH
④ Ba(OH)2 ⑤ NaOH ⑥ CH3COONa ⑦ KCl ⑧ NH4Cl,溶液PH由大到小的顺序是(填写编号)
(5)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是 ________ 。
查看答案和解析>>
科目:高中化学 来源:2010年安丘中学高二暑期练习化学卷(四) 题型:实验题
⑴下列实验操作或对实验事实的叙述正确的是 (填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“吱吱”的响声;
③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
④向可能含有SO42-、SO32-的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验SO42-的存在;
⑤蒸发NaCl溶液以得到NaCl固体时,不必将溶液蒸干;
⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备Fe(OH)3胶体;
⑦如图,可观察到灵敏检流计的指针偏转;
⑧向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶 液的现象相同。
⑵现有0.1mol·L-1的纯碱溶液,用pH试纸测定该溶液的pH,其
正确的操作是
你认为该溶液pH的范围一定介于 之间。请你设计一个简单的实验方案证明纯碱溶液呈碱性是由CO32-引起的: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省漳州市八校高三第三次联考理综化学试卷(解析版) 题型:填空题
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
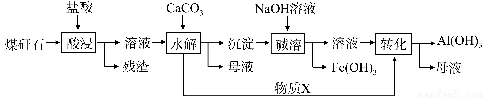
(1)“酸浸”过程中主要反应的离子方程式为__________?? 、____________。
(2)“酸浸”时铝浸出率的影响因素可能有_____? ________、_____? ______。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的主要离子方程式为:Fe3++3OH- = Fe(OH)3↓;??????????????????? ????????????????? 。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是?????????????????????? 。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:???????????????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2012届山西省高二上学期期末考试化学试卷 题型:填空题
(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L
(2)已知下列物质在20 ℃下的Ksp如下:
|
化学式 |
AgCl |
AgBr |
AgI |
|
颜 色 |
白色 |
浅黄色 |
黄色 |
|
Ksp |
2.0×10-10 |
5.4×10-13 |
8.3×10-17 |
①20℃时,上述三种银盐的饱和溶液中,Ag+物质的量浓度由大到小的顺序是:
。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br-)/c(Cl-)= 。
(3)物质的量浓度相同的①氨水、②氯化铵、③碳酸氢铵、④硫酸氢铵、⑤硫酸铵5种溶液中,c(NH)的大小顺序是 (填序号)。
(4)浓度均为0.1mol/L的8种溶液 ① HNO3 ② H2SO4 ③ CH3COOH
④ Ba(OH)2 ⑤ NaOH ⑥ CH3COONa ⑦ KCl ⑧ NH4Cl,溶液PH由大到小的顺序是(填写编号)
(5)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是 ________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com