
| A. | 一定温度下,反应2H2O(l)═2H2(g)+O2(g)的△H>0△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量NaCl晶体,平衡逆向移动,Ksp减小 |
分析 A.根据反应类型和物质状态的变化判断焓变和熵变;
B.水解反应为吸热反应;
C.根据加入催化剂或升高温度都能加快反应速率判断;
D.沉淀溶解平衡温度不变,溶度积不变,加入氯化钠平衡左移,离子浓度乘积不变.
解答 解:A.一定温度下,反应2H2O(l)═2H2(g)+O2(g),该反应为分解反应,属于吸热反应,即△H>0;由于反应后气体的物质的量增大,所以熵增大,即△S>0,故A正确;
B.水解反应为吸热反应,所以升高温度水解平衡正向移动,故B错误;
C.加入催化剂或升高温度都能加快反应速率,所以对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率,故C正确;
D.AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,但温度不变Ksp不变,故D错误;
故选BD.
点评 本题考查了熵变和焓变、水解平衡的移动、沉淀溶解平衡,侧重于对反应原理的应用的考查,属于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 光导纤维是以二氧化硅为主要原料制成的 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 绿色食品是指不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol/(L•S) | B. | 0.3 mol/(L•S) | C. | 0.6 mol/(L•S) | D. | 0.9 mol/(L•S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 v(C)正=3v(D)逆 | |
| B. | 若升高温度最终能生成更多的C和D | |
| C. | 单位时间里有4n mol A消耗,同时有5n mol B生成 | |
| D. | 容器里A、B、C、D的浓度比一定是4:5:4:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符号 | ② | ③ | ④ | ⑤ |
| 原子半径 | 130 | 118 | 75 | 73 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
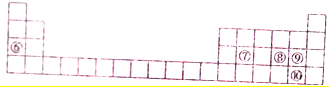
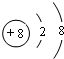 ;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)
;所给元素中,其含氧化合物能用于漂白,该元素可能是S、Cl(填元素符号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2、Cl2、Br2、I2的熔点、沸点逐渐升高 | |
| B. | Li、Na、K、Rb熔沸点依次减弱 | |
| C. | 金刚石的硬度、熔点、沸点都高于晶体硅 | |
| D. | NaF、NaCl、NaBr、NaI的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若化合物M其原子个数比为14:4:5:1:1,则其化学式为[Cu(NH3)4]SO4•H2O | |
| B. | 若该化合物为配合物,则E离子给出孤对电子 | |
| C. | C元素与D元素形成的一种具有较强还原性的分子的VSEPR模型为平面三角形 | |
| D. | DC42-空间构型为正四面体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com