
下列说法中正确的是( )
A.在气体单质分子中,一定含有σ键,可能含有π键
B.烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键
C.等电子体结构相似,化学性质相同
D.共价键的方向性决定了原子在形成分子时相互结合的数量关系
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
乙醇燃料电池中采用磺酸类质子溶剂,在一定温度下供电,电池总反应为C2H5OH+3O2===2CO2+3H2O,电池示意图如图。下列说法中错误的是 ( )
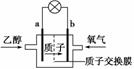
A.电池工作时,质子向电池的正极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a极上发生的电极反应是C2H5OH+3H2O+12e-===2CO2+12H+
D.b极上发生的电极反应是4H++O2+4e-===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.常温下浓硫酸能与铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸
D. 二氧化氯具有还原性,可用于自来水的杀菌消毒
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,不正确的是
A.原子半径:X>Y>W>Z B.原子序数:Y>X>Z>W
C.原子最外层电子数:Z>W>Y>X D. 离子半径:X+>Y2+>W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
用价层电子对互斥理论预测NH3和BF3的空间构型,结论正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.三角锥形;平面三角形 D.直线形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有折线型结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于乙醇的说法中正确的是( )
A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
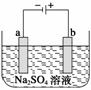 右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象描述正确的是 ( )
右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象描述正确的是 ( )
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com