
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )

A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e- === 4OH-
B.若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D
【解析】
试题分析:原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应,因此在该燃料电池中氢气在负极通入,氧气在正极通入,则A、该燃料电池的电解质显酸性,则燃料电池工作时,正极反应为:O2 + 4H+ + 4e- ===2H2O,A不正确;B、a极与燃料电池的正极相连,因此若a极是铁,b极是铜时,铁是阳极,铜是阴极,a极逐渐溶解,B不正确;C、若a、b极都是石墨,a电极是阳极,溶液中的氢氧根放电产生氧气,在相同条件下a极产生的气体与电池中消耗的H2体积不相等,后者是前者的2倍,C不正确;D、若a极是粗铜,b极是纯铜时,则相当于粗铜的精炼,所以a极逐渐溶解,b极上有铜析出,D正确,答案选A。
考点:考查电化学原理的应用


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列有关离子键、共价键的叙述中正确的是( )
A.离子化合物中只存在离子键,没有共价键
B.构成单质分子的粒子中一定含有共价键
C.共价化合物分子中一定不存在离子键
D.仅由非金属元素组成的化合物中一定不含离子键
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
反应X(g)+Y(g) 2Z(g); ΔH<0,达到平衡时,下列说法正确的是
2Z(g); ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是
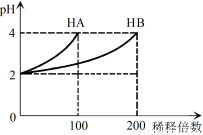
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:填空题
【选修3:物质结构与性质】(10分)
血红素中含有C、O、N、Fe五种元素。回答下列问题:
(1)C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
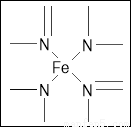
(2)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有 ,在右图的方框内用“→”标出Fe2+的配位键。
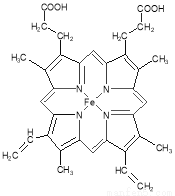
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
2N2H4(l)+ N2O4(l)=3N2(g)+ 4H2O(g) △H=-1038.7kJ/mol
若该反应中有4mol N—H键断裂,则形成的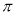 键有___________mol。
键有___________mol。
(5)根据等电子原理,写出CN—的电子式 ,1 mol O22+中含有的π键数目为 。
(6)铁有δ、γ、α三种同素异形体如下图所示。则γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
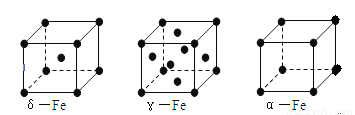
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. 服用铬含量超标的药用胶囊会对人对健康造成危害
B. 食用一定量的油脂能促进人体对某些维生素的吸收
C.CH4和Cl2在光照条件下反应的产物最多可能有四种
D.无论乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列说法中不正确的是( )
A.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致。
B.绿色化学的核心是从源头上消除工业生产对环境的污染。
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈。
D.华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列数据是对应物质的熔点:
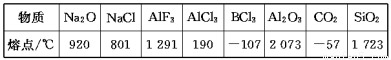
据此做出的下列判断中错误的是( )
A.铝的化合物的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com