
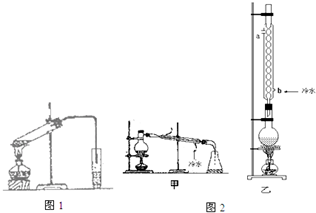
 已知如表数据:
已知如表数据:| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
分析 (1)乙酸、乙醇和浓硫酸混合时相当于浓硫酸稀释,所以应该将浓硫酸加入乙醇和乙酸的混合溶液中,并不断振荡;
(2)在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应生成乙酸乙酯;浓硫酸具有吸水性和催化能力;
(3)乙酸、乙醇、乙酸乙酯沸点接近且较低,温度高时三者都易挥发;
(4)乙酸乙酯是难溶于碳酸钠溶液的无色液体,碳酸钠溶液呈碱性,酚酞遇碱变红色,所以碳酸钠溶液呈红色,生成的乙酸乙酯中含有乙醇和乙酸,乙醇极易溶于水,乙酸和碳酸钠反应生成乙酸钠、二氧化碳和水,导致溶液碱性降低;
(5)分离互不相溶的液体采用分液方法,分液所用的仪器是分液漏斗;为防止分离出的液体中含有杂质;
(6)甲、乙的区别是乙装置能冷凝回流.
解答 解:(1)乙酸、乙醇和浓硫酸混合时相当于浓硫酸稀释,所以应该将浓硫酸加入乙醇和乙酸的混合溶液中,并不断振荡,防止局部温度过高而产生安全事故,
故答案为:先加乙酸和乙醇各4mL,再缓缓加入1mL浓H2SO4,边加边振荡;
(2)在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应生成乙酸乙酯,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;浓硫酸具有吸水性和催化能力,所以该反应中浓硫酸作催化剂和吸水剂,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;催化剂、吸水剂;
(3)乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失,降低产率,所以用小火加热,
故答案为:乙酸、乙醇、乙酸乙酯沸点接近且较低,大火加热,反应物大量蒸发损失;
(4)乙酸乙酯是难溶于碳酸钠溶液的无色液体,碳酸钠溶液呈碱性,酚酞遇碱变红色,所以碳酸钠溶液呈红色,生成的乙酸乙酯中含有乙醇和乙酸,乙醇极易溶于水,乙酸和碳酸钠反应生成乙酸钠、二氧化碳和水,导致溶液碱性降低,所以看到的现象是在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄,
故答案为:在浅红色Na2CO3溶液上层有约4cm厚的无色液体,振荡后Na2CO3溶液层红色变浅,有气泡,上层液体变薄;上层是油层因为生成的乙酸乙酯难溶于水,且密度比水小,同时因为挥发出来的乙酸与碳酸钠反应,放出CO2气体,所以有气泡出现;
(5)分离互不相溶的液体采用分液方法,分液所用的仪器是分液漏斗,乙酸乙酯密度小于水,所以应该从上口倒出,
故答案为:分液漏斗;上;乙酸乙酯比水密度小;
(6)甲、乙的区别是乙装置能冷凝回流,提高产率,所以选乙,故答案为:乙;反应物能冷凝回流.
点评 本题考查物质制备,为高频考点,明确实验步骤及实验原理是解本题关键,侧重考查实验操作、实验分析能力,知道碳酸钠溶液作用,易错点是(6)题,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:填空题
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号[ | H | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)该反应的离子方程式为____________________________;
(2)探究温度对化学反应速率影响的实验编号是 ,探究反应物浓度对化 学反应速率影响的实验编号是 ;
学反应速率影响的实验编号是 ;
(3)实验①测得K MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
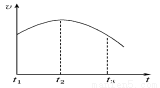
(4)该反应的速率v和时间t的关系如图所示,在t1~t2时段反应速率________(填“加快”或“减慢”或“变化不明显”),主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
模型法是化学中把微观问题宏观化的最常见方法,对于反应2HBr(g) H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是
H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是
A.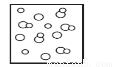 B.
B.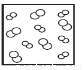 C.
C.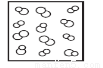 D.
D.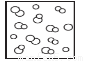
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
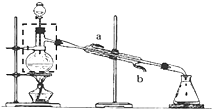 某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:
某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.
Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
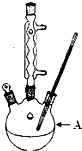 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)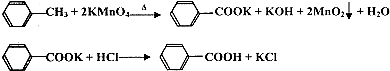
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com