
| A. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ•mol-1 | |
| B. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ•mol-1 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ•mol-1 | |
| D. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ•mol-1 |
分析 燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,注意产物是液态水,焓变为负值等,以此解答该题.
解答 解:A.戊烷的燃烧热为1mol液态戊烷完全燃烧生成液态水时放出热量,其燃烧热的热化学方程式为:C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ•mol-1,故A正确;
B.燃烧热的热化学方程式中水的状态不能为气体,故B错误;
C.水不能为气体,且燃烧为放热反应,其焓变应该为负值,故C错误;
D.戊烷的燃烧为放热反应,其焓变必须为负值,故D错误;
故选A.
点评 本题考查反应热与焓变的应用,题目难度不大,明确燃烧热的概念为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:推断题
 .
. ,写出由该物质制备D的一种常见单质的反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;
,写出由该物质制备D的一种常见单质的反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g),△H<0体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g),△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 W、X、Y、Z 是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知 Y、Z 两种元素的单质是空气的主要成分,W 原子的最外层电子数与 Ne 原子的最外层电子数相差 1.
W、X、Y、Z 是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知 Y、Z 两种元素的单质是空气的主要成分,W 原子的最外层电子数与 Ne 原子的最外层电子数相差 1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
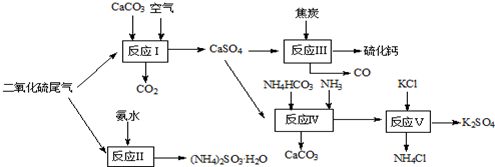
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学课外小组查阅资料得知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应.他们设计了如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中.如图是制取溴苯的装置.试回答:
某化学课外小组查阅资料得知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应.他们设计了如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中.如图是制取溴苯的装置.试回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com