
【题目】鉴别FeCl3溶液与Fe(OH)3胶体最简便的方法是
A. 蒸发 B. 过滤 C. 萃取 D. 丁达尔效应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学欲大量配制含有下列四种不同阴、阳离子的溶液,其中能配制成功的是
A. K+、H+、Cl-、CO32- B. Mg2+、Al3+、Cl-、SO42-
C. Na+、H+、NO3-、Fe2+ D. Na+、Ba2+、HCO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
序号 | a | b | c | d | e | f |
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为________。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是________________(用离子方程式表示)。
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有__(填字母代号)。
A.pH=8. 8的NaOH溶液
B.pH=5. 2的NH4Cl溶液
C.pH=5. 2的盐酸
D.0. 1 mol/L的NaCN溶液
E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有_____。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B.2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C.c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D.c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关生活中常见的有机物的说法正确的是( )
A.汽油、苯、乙醇都属于烃类物质
B.油脂皂化后可用盐析的方法使高级脂肪酸钠和甘油分离
C.乙醇能被氧化成乙酸,两者都能与氢氧化钠溶液反应
D.煤的干馏可得煤油,甲烷、乙烯和苯能从石油分馏得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是( )
pC(g)+qD(g) ΔH<0。下列结论中错误的是( )
A. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
B. 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的1.8倍,则m+n > p+q
C. 若m+n = p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若温度不变缩小容器体积,达到新平衡时压强增大到原来的2倍,则体积一定小于原来的1/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.除0族元素外,短周期元素的最高正化合价都等于该元素的族序数
B.除第1周期外,其他周期均含有18种元素
C.副族元素中不含非金属元素
D.碱金属元素是指第ⅠA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A. 在自然界中只以化合态的形式存在
B. 单质常用作左半导体材料和光导纤维
C. 最高价氧化物不与酸反应
D. 气态氢化物比甲烷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)已知2A2(g)+B2(g)![]() 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
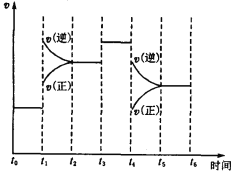
(1)比较a___b(填“>、=、<”)
(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(3)下图表示此反应的反应速率v和时间t的关系图。根据下图判断,在t1和t4时刻改变的外界条件分别是_______________和 _____________ 。
(二)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
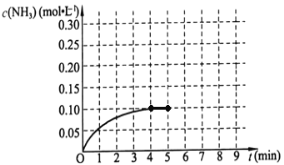
(1)根据上图,该反应达到平衡时H2的转化率等于__________。
(2)第5分钟末,保持其它条件不变,若改变反应温度,达新平衡后NH3的物质的量浓度不可能为_________。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1 c 0.10 mol·L-1 d 0.08 mol·L-1
(3)若在第5分钟末将容器的体积缩小一半后,在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟到9分钟NH3浓度的变化曲线。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A. 浓度均为lmol/L的醋酸和醋酸钠溶液等体积混合,溶液中CH3COOH和CH3COO—的总数为2NA
B. 1molP4所含共价键数目为4mol
C. 1 mol K2S与K2S2的混合物中含离子总数为3NA
D. 25 ℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com