
| A. | Mg>Al>Ca | B. | Al>Na>Li | C. | Al>Mg>Ca | D. | Mg>Ba>Al |
分析 在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高,据此分析解答.
解答 解:在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高,
A.价电子数Al>Mg=Ca,原子半径Ca>Mg>Al,所以金属熔沸点:Al>Mg>Ca,故A错误;
B.价电子数Al>Li=Na,原子半径Na>Al>Li,元素金属熔沸点Al>Li>Na,故B错误;
C.价电子数Al>Mg=Ca,原子半径Ca>Mg>Al,所以金属熔沸点:Al>Mg>Ca,故C正确;
D.价电子数Al>Mg=Ba,原子半径Ba>Mg>Al,所以金属熔沸点:Al>Mg>Ba,故D错误;
故选C.
点评 本题考查金属晶体熔沸点高低判断,为高频考点,明确金属晶体熔沸点高低影响因素是解本题关键,熟练掌握原子半径大小规律,题目难度不大.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解池的阳极上发生氧化反应,阴极上发生还原反应 | |
| B. | 原电池跟电解池连接后,电子从原电池负极流向电解池阴极 | |
| C. | 电镀时,电镀池里的阳极材料发生氧化反应 | |
| D. | 电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
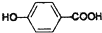
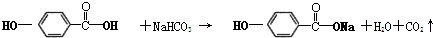 ,
,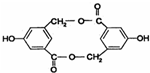 ,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.
,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.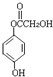 等(只写一种).
等(只写一种).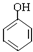 .
.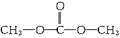 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
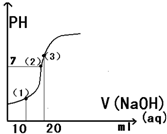 常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )
常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )| A. | 点(1)所示溶液中:C(CH3COOH)+C(H+)=C(CH3COO-)+C(OH-) | |
| B. | 点(2)所示溶液中:C(Na+)=C(CH3COO H )+C(CH3COO-) | |
| C. | 点(3)所示溶液中:C(Na+)>C(OH-)>C(CH3COO-)>C(H+) | |
| D. | 滴定过程中可能出现:C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
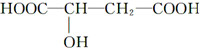
| A. | 1mol苹果酸在一定条件下能与足量钠反应生成3mol氢气 | |
| B. | 苹果酸在一定条件下能催化氧化生成醛 | |
| C. | 苹果酸在一定条件下能发生加聚反应生成高分子化合物 | |
| D. | 1 mol苹果酸与NaHCO3溶液反应最多消耗2 mol NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
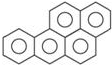 苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )
苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )| A. | 10,30 | B. | 10,32 | C. | 11,30 | D. | 11,32 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
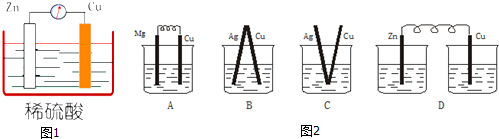
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com