
| A. | 臭氧与空气中的氮氧化合物发生作用后会产生光化学烟雾,对人体健康、植物成长等都有很大危害 | |
| B. | 农业废弃物、城市与工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物哪个)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
分析 A.光化学烟雾为臭氧与颗粒物形成的有毒烟雾;
B.生物质能就是太阳能以化学能形式贮存在生物质中的能量形式,即以生物质为载体的能量.它直接或间接地来源于绿色植物的光合作用,可转化为常规的固态、液态和气态燃料,取之不尽、用之不竭,是一种可再生能源;
C.分光光度计,又称光谱仪,是将成分复杂的光,分解为光谱线的科学仪器,通过谱线的变化可以确定物质浓度的变化,从而确定化学反应速率;
D.某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等.
解答 解:A.光化学烟雾为臭氧与颗粒物形成的有毒烟雾,可由氮氧化物导致,对人体有害,故A错误;
B.生物质能就是太阳能以化学能形式贮存在生物质中的能量形式,即以生物质为载体的能量.它直接或间接地来源于绿色植物的光合作用,可转化为常规的固态、液态和气态燃料,取之不尽、用之不竭,是一种可再生能源,故B正确;
C.分光光度计,又称光谱仪,是将成分复杂的光,分解为光谱线的科学仪器,通过谱线的变化可以确定物质浓度的变化,从而确定化学反应速率,故C正确;
D.某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等,故D正确;
故选:A.
点评 本题考查了化学与生活,涉及环境的污染与治理、能量的转化、物质的用途,题材新颖,是高考的热点,题目难度不大,注意相关知识的积累.


科目:高中化学 来源: 题型:解答题
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.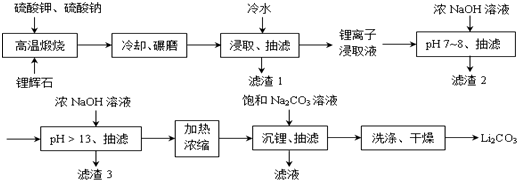
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤液化制得清洁能源 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 从海水中提取氯化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2固体中含离子总数为4NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | VL amol•L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
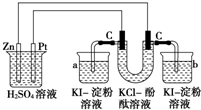 按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b}{(a+b)×1{0}^{7}}$ | B. | $\frac{b}{(a-b)×1{0}^{7}}$ | C. | $\frac{b}{(a-b)×1{0}^{5}}$ | D. | $\frac{a-b}{a×1{0}^{7}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: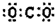 | |
| B. | 基态Fe原子的外围电子排布图为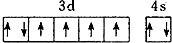 | |
| C. | 在基态多电子原子中,P轨道电子能量一定高于s轨道电子能量 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com