

£Ø1£©¼×ČŻĘ÷“ļµ½Ę½ŗāŹ±SO2µÄ×Ŗ»ÆĀŹŹĒ____________£¬ĘäĖłŠčŹ±¼ä____________50 s(Ģī”°“óÓŚ”±”°Š”ÓŚ”±»ņ”°µČÓŚ”±)”£
£Ø2£©“ļµ½Ę½ŗāדĢ¬ŗó£¬ŅŖŹ¹¼×”¢ŅŅĮ½ČŻĘ÷ÖŠSO2ĪļÖŹµÄĮæĻąµČ£¬æɲÉČ”µÄ“ėŹ©ŹĒ____________£ØĢī×ÖÄø£©”£
A.±£³ÖĪĀ¶Č²»±ä£¬ŹŹµ±Ą©“ó¼×ČŻĘ÷µÄČŻ»ż
B.±£³ÖČŻ»ż²»±ä£¬Ź¹ŅŅČŻĘ÷ÉżĪĀ
C.±£³ÖČŻ»żŗĶĪĀ¶Č²»±ä£¬ĻņŅŅČŻĘ÷ÖŠ¼ÓČėŹŹĮæSO3£Øg£©
D.±£³ÖČŻ»żŗĶĪĀ¶Č²»±ä£¬Ļņ¼×ČŻĘ÷ÖŠ¼ÓČėŹŹĮæSO3£Øg£©
£Ø1£©90% Š”ÓŚ
£Ø2£©AD
½āĪö£ŗ£Ø1£©2SO2(g)+O2(g)====2SO3(g) n£Ø×Ü£©
Ęš/mol£ŗ 4 2 0 6
±ä/mol£ŗ £æ=3.6 ?=1.8
Ę½/mol£ŗ 4.2
¦Į(SO2)=![]() ”Į100%=90%”£ĻņÓŅ·“Ó¦½ØĮ¢Ę½ŗāµÄ¹ż³ĢÖŠĘųĢå×ܵÄĪļÖŹµÄĮæ¼õÉŁ£¬ŗćŃ¹ČŻĘ÷¼×µÄČŻ»ż²»¶Ļ¼õŠ”£¬·“Ó¦ĖŁĀŹ±ČŅŅČŻĘ÷ÖŠµÄæģ£¬Ōņ“ļµ½Ę½ŗāĖłÓĆŹ±¼äŠ”ÓŚ50 s”£
”Į100%=90%”£ĻņÓŅ·“Ó¦½ØĮ¢Ę½ŗāµÄ¹ż³ĢÖŠĘųĢå×ܵÄĪļÖŹµÄĮæ¼õÉŁ£¬ŗćŃ¹ČŻĘ÷¼×µÄČŻ»ż²»¶Ļ¼õŠ”£¬·“Ó¦ĖŁĀŹ±ČŅŅČŻĘ÷ÖŠµÄæģ£¬Ōņ“ļµ½Ę½ŗāĖłÓĆŹ±¼äŠ”ÓŚ50 s”£
£Ø2£©“ļµ½Ę½ŗāדĢ¬ŗó¼×ČŻĘ÷ÄŚSO2µÄĪļÖŹµÄĮæÉŁÓŚŅŅČŻĘ÷ÄŚSO2µÄĪļÖŹµÄĮ攣ÓūŹ¹Į½ČŻĘ÷ÄŚSO2µÄĪļÖŹµÄĮæĻąµČ£¬Ó¦øĆŌö¼Ó¼×ČŻĘ÷ÄŚSO2µÄĪļÖŹµÄĮ攣A“ėŹ©ÄÜŹ¹Ę½ŗāדĢ¬Ļņ×óŅĘ¶Æ£¬“Ó¶ųÄÜŌö“ó¼×ČŻĘ÷ÖŠSO2µÄĪļÖŹµÄĮ攣D“ėŹ©²»ÄÜŹ¹Ę½ŗāדĢ¬·¢Éś±ä»Æ£¬µ«æÉŅŌŌö“ó¼×ČŻĘ÷ÄŚSO2µÄĪļÖŹµÄĮ攣B”¢CĮ½“ėŹ©¶¼²»ÄÜŌö¼Ó¼×ČŻĘ÷ÄŚSO2µÄĪļÖŹµÄĮ攣


 ĆæČÕ10·ÖÖÓæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
ĆæČÕ10·ÖÖÓæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

(1)ŌŚ“ļµ½Ę½ŗāדĢ¬ĻņAµÄČŻĘ÷ÖŠĶØČėÉŁĮæO2£¬ĢåĻµÖŠSO2µÄĢå»ż·ÖŹż____________(Ģī”°Ōö“ó”± ”°¼õŠ””±»ņ”°²»±ä”±)£¬ČōŅŖŹ¹SO2µÄĢå»ż·ÖŹżŌŁ±äµ½ÓėĘ½ŗāדĢ¬AĻąĶ¬£¬æɲÉČ”µÄ“ėŹ©ÓŠ£ŗ____________»ņ____________”£
(2)ČōĘšŹ¼Ź±a=1.2 mol£¬b=0.6 mol£¬ĒŅ“ļµ½Ę½ŗāŗóø÷ĘųĢåµÄĢå»ż·ÖŹżÓėĘ½ŗāדĢ¬AĻąĶ¬£¬ŌņĘšŹ¼Ź±cµÄȔֵĪŖ____________”£
(3)ČōŅŖŹ¹·“Ó¦æŖŹ¼Ź±ĻņÄę·“Ó¦·½Ļņ½ųŠŠ£¬ĒŅ“ļµ½Ę½ŗāŗóø÷ĘųĢåµÄĪļÖŹµÄĮæÓėĘ½ŗāדĢ¬AĻąĶ¬£¬ŌņĘšŹ¼Ź±cµÄȔֵ·¶Ī§ŹĒ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
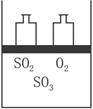
(1)ŌŚøĆĘ½ŗāדĢ¬Ź±n(SO3)=________£»
(2)ČōĘšŹ¼Ź±¼ÓČė1.2 mol SO2”¢0.6 mol O2ŗĶx mol SO3£¬“ļµ½Ę½ŗāדĢ¬ŗó£¬ø÷ĘųĢåµÄĢå»ż·ÖŹżÓėÉĻŹöĘ½ŗāדĢ¬ĻąĶ¬£¬xµÄȔֵĪŖ________________£»
(3)Čō·“Ó¦æŖŹ¼Ź±µÄv(Äę)£¾v(Õż)£¬“ļµ½ÉĻŹöĘ½ŗāדĢ¬Ź±£¬ĘųĢåµÄ×ÜĪļÖŹµÄĮæČŌĪŖ4.2 mol”£ŌņĘšŹ¼Ź±n(SO3)µÄȔֵ·¶Ī§ŹĒ________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½«4 mol SO2ŗĶ2 mol O2ĘųĢåŌŚ2L LµÄČŻĘ÷ÖŠ»ģŗĻ£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗ2SO2(g)£«O2 (g) 2SO3 (g)”£Čō¾¹ż2sŗó²āµĆSO3µÄÅضČĪŖ0.6 mol/ L£¬ŹŌ¼ĘĖć£ŗ(1)V(O2)£»(2)SO2µÄ×Ŗ»ÆĀŹ£»(3)2sŹ±µÄO2ÅØ¶Č”££Ø5·Ö£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğøŹĖąŹ”½š²żŹŠµŚŅ»ÖŠŃ§øßŅ»ĘŚÖŠæ¼ŹŌ£ØĄķ£©»ÆѧŹŌ¾ķ £Ø“ų½āĪö£© ĢāŠĶ£ŗ¼ĘĖćĢā
(6·Ö)½«4 mol SO2ŗĶ2 mol O2ĘųĢåŌŚ2LµÄČŻĘ÷ÖŠ»ģŗĻ£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗ2SO2(g)£«O2 (g) 2SO3 (g)Čō¾¹ż2sŗó²āµĆSO3µÄÅضČĪŖ0.6 mol/ L£¬ŹŌ¼ĘĖć£ŗ
2SO3 (g)Čō¾¹ż2sŗó²āµĆSO3µÄÅضČĪŖ0.6 mol/ L£¬ŹŌ¼ĘĖć£ŗ
”¾Š”Ģā1”æv(O2)£»
”¾Š”Ģā2”æSO2µÄ×Ŗ»ÆĀŹ£»
”¾Š”Ģā3”æ2sŹ±µÄO2ÅØ¶Č”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģŗŚĮś½Ź”øßŅ»ĻĀŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
£Ø6·Ö£©½«4 mol SO2ŗĶ2 mol O2ŌŚ2 LµÄĆܱÕČŻĘ÷ÖŠ»ģŗĻ£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗ2SO2(g)£«O2(g) 2SO3(g)”£Čō¾¹ż2sŗó²āµĆSO3µÄÅضČĪŖ0.6 mol/ L£¬ÓĆŃõĘų±ķŹ¾øĆ·“Ó¦2sÄŚµÄĘ½¾łĖŁĀŹV(O2)£½
£»2sÄ©O2ÅضČĪŖ
£»2sÄ©SO2µÄ×Ŗ»ÆĀŹĪŖ
ӣ
2SO3(g)”£Čō¾¹ż2sŗó²āµĆSO3µÄÅضČĪŖ0.6 mol/ L£¬ÓĆŃõĘų±ķŹ¾øĆ·“Ó¦2sÄŚµÄĘ½¾łĖŁĀŹV(O2)£½
£»2sÄ©O2ÅضČĪŖ
£»2sÄ©SO2µÄ×Ŗ»ÆĀŹĪŖ
ӣ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com