
| A. | 铁与氯气反应 | B. | 次氯酸的分解 | ||
| C. | 乙醇与乙酸的酯化反应 | D. | 甲烷与氧气的反应 |
分析 光照条件下,次氯酸易分解,氯气与甲烷发生取代反应,氯气与氢气发生化合反应,氯气与铁、甲烷与氧气在点燃的条件下反应,光照条件下不反应.
解答 解:A.氯气与铁在点燃条件下反应,故A错误;
B.次氯酸不稳定性,在光照条件下发生:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2,故B正确;
C.乙醇与乙酸在浓硫酸作用下加热反应,光照条件下不反应,故C错误;
D.甲烷与氧气在点燃的条件下反应,光照条件下不反应,故D错误;
故选B.
点评 本题考查常见物质的性质,为高频考点,注意在光照条件下能发生反应的物质,注重常见相关物质的性质等知识的积累,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+=H2O | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的结构式:O=C=O | |
| B. | S2-的结构示意图: | |
| C. | R2+离子核外有a个电子,b个中子,R原子符号为:${\;}_{a+2}^{a+b+2}$R | |
| D. | 次氯酸的电子式: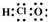 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过煤的直接或间接液化可以获得各种芳香烃 | |
| B. | 通过石油的催化重整等工艺可获取芳香烃 | |
| C. | 石油的裂化的目的主要是为了提高轻质油的产量 | |
| D. | 石油的裂解的目的主要是为了获取不饱和烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
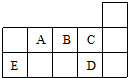
| A. | ED4分子中各原子均达8电子结构 | |
| B. | AD3和ED4两分子的中心原子均为sp3杂化 | |
| C. | A、B、C第一电离能的大小顺序为C>B>A | |
| D. | C、D气态氢化物稳定性强弱和沸点高低均为C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的成分为次氯酸钙,是纯净物 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理SO2和HCl废气 | |
| D. | 干燥Cl2可使干燥有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com