
(8分)用实验确定某酸HA是弱电解质,两同学的方案是:
甲:①称取一定质量的配制
的溶液
;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各;
②分别取这两种溶液各,加水稀释为
;
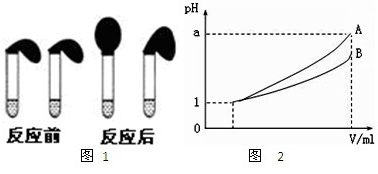
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH_______1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是_________(多选扣分)
(a)装溶液的试管中放出
的速率快;
(b)装HA溶液的试管中放出的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你再提出一个合理且比较容易进行的方案(药品可任取),作简明扼要表述____________________________________。
科目:高中化学 来源: 题型:阅读理解
 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:| 1 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com