

 Al2O3 + 3 H2O (4分)
Al2O3 + 3 H2O (4分) Al2O3 + 3 H2O。
Al2O3 + 3 H2O。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| 元素 | 钠 | 镁 | 铝 | 硅 |
| 电负性 | 0.9 | 1.2 | χ | 1.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
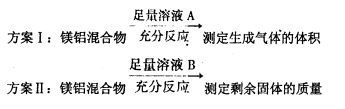
| A.溶液A选用NaOH溶液 |
| B.若溶液B选用浓硝酸,则测得镁的质量分数偏小 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na和K | B.Mg和Al | C.Cu和Al | D.Al和Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
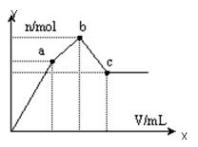
| A.a点对应的沉淀只有BaSO4 |
| B.c点溶液呈碱性 |
| C.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| D.c点加入Ba(OH)2溶液的体积为200 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
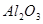 ,含有杂质
,含有杂质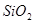 、
、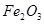 、
、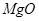 。工业上从铝土矿中提取铝可采用如下工艺流程:
。工业上从铝土矿中提取铝可采用如下工艺流程: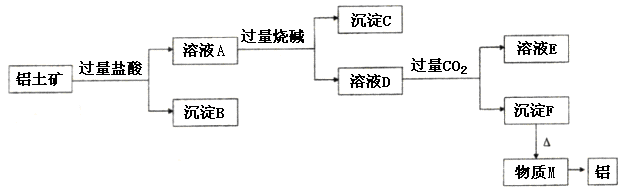
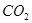 生成沉淀F的离子方程式为_______________________。
生成沉淀F的离子方程式为_______________________。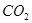 换成加入过量盐酸? (填 能 或 不能)
换成加入过量盐酸? (填 能 或 不能)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
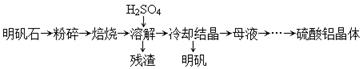
| 物质 | α-Al2O3 | γ-A12O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α- Al2O3 |
| 温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤⑥ | B.只有①③ | C.只有②③ | D.①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com