
【题目】根据问题进行作答:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ( )
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2CO(g)+O2(g)=2CO2(l)△H<0
D.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池,其正极的电极反应式为:
(3)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是:
(4)利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于 (填M或者N)处,此时溶液中的阴离子向 极(填X或铁)移动.
【答案】
(1)C,D
(2)O2+4H2O+4e﹣=4OH﹣
(3)阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+的浓度恒定
(4)N,X
【解析】(1)A.C(s)+CO2(g)=2CO(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A不符合题意;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0,不属于氧化还原反应,不能设计为原电池,故B不符合题意;
C.2CO(g)+O2(g)=2CO2(l)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C符合题意;
D.2H2(g)+O2(g)═2H2O(l)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故D符合题意.
所以答案是:CD.
(2)正极上氧化剂得电子发生还原反应,以KOH溶液为电解质溶液,则正极电极反应式为:O2+4 H2O+4e﹣=4OH﹣,
所以答案是:O2+4 H2O+4e﹣=4OH﹣.
(3)电镀铜时用铜做阳极,阳极上铜被氧化,电解质溶液浓度不变,用铜作电极可及时补充电镀液中消耗的Cu2+,保持其浓度恒定,采用石墨无法补充Cu2+,所以答案是:阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+的浓度恒定.
(4)电极材料是铁和碳棒,铁比碳活泼,所以为减缓铁的腐蚀,必须将其设计成电解池,且铁作阴极,碳棒作阳极,该保护法的名称是外加电流的阴极保护法,则开关K应该置于N,溶液中阴离子向阳极即X极移动;
所以答案是:N;X.
【考点精析】通过灵活运用金属的电化学腐蚀与防护,掌握金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法即可以解答此题.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列有关反应的叙述不正确的是
A.有元素化合价发生变化的反应一定是氧化还原反应
B.分解反应的反应物只有一种
C.化合反应的生成物只有一种
D.有单质生成的反应一定是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验事故或废弃药品的处理方法不正确的是
A.当有大量毒气泄漏时,人应沿逆风方向疏散
B.实验室里电线失火,首先要断开电源
C.当少量浓硫酸沾在皮肤上,应立即用3%-5%氢氧化钠溶液冲洗
D.酒精失火用湿抹布盖灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性废水中的NH4+可在一定条件下利用硝酸盐菌转化为NO3-,再用图示的电化学装置除去NO3-下列有关说法正确的是
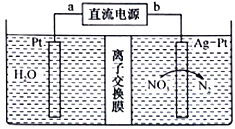
A. a端是直流电源的负极
B. 该装置把化学能转化为电能
C. 图中离子交换膜应为阴离子交换膜
D. 阴级的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)△H=a kJmol﹣1 , 反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答: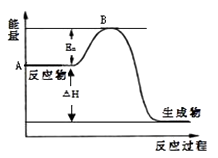
(1)图中A点表示 , a= .
(2)Ea的大小对该反应的△H(填“有”或“无”)影响.
(3)已知常温常压下单质硫的燃烧热为296kJmol﹣1 , 由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
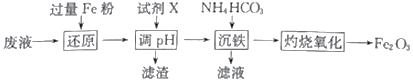
已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】磷化硼(BP)是一种受关注的耐磨涂层材料,可作为钛等金属表面的保护薄膜。
(1)三溴化硼和三溴化磷混合物在高温条件下与H2反应可以制得BP。
①上述反应的化学方程式为________________________;
②磷原子中存在_____种不同能量的电子,电子占据的最高能层符号为_______。
③常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该物质属于______晶体(填晶体类型)。
(2)已知磷酸是中强酸,硼酸是弱酸;pKa= -lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH >CH3COOH。据此推测,pKa:AtCH2COOH____ClCH2COOH(填“>”、“<”、“=”)
②磷酸是三元酸,写出两个与PO43-具有相同空间构型和键合形式的分子或离子_________________。
③硼酸是一元酸,它在水中表现出来的弱酸性,并不是自身电离出氢离子所致,而是水分子与B(OH)3结合,生成一个酸根离子,该阴离子的结构式为:_________(若存在配位键,请用箭头标出)。
(3)高温陶瓷材料Si3N4的成键方式如图1所示,结构中N—Si—N的键角比Si—N—Si的键角大,其原因是_____________________________________。
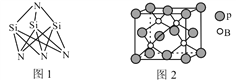
(4)磷化硼的晶体结构如图2所示。晶胞中P原子的堆积方式为________(填“简单立方”、“体心立方”或“面心立方最密”)堆积。若该晶体中最邻近的两个P原子之间的距离为a nm,则晶体密度为__________g·cm-3(只需列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com