
| A. | 二氧化硫具有较强的还原性,故不能用浓硫酸干燥 | |
| B. | 苯、溴水、铁粉混合可制成溴苯 | |
| C. | 苯在一定条件下既能发生取代反应,又能发生加成反应,但不能发生氧化反应 | |
| D. | FeCl3溶液可以腐蚀线路板上的Cu,不能说明Cu的金属活动性大于Fe |
分析 A.二氧化硫与浓硫酸不反应;
B.苯与溴水不反应;
C.苯易取代、难加成、能氧化;
D.Cu与氯化铁反应生成氯化亚铁、氯化铜.
解答 解:A.二氧化硫与浓硫酸不反应,则二氧化硫具有较强的还原性,能用浓硫酸干燥,故A错误;
B.苯与溴水不反应,利用苯、液溴、铁粉混合可制成溴苯,故B错误;
C.苯易取代、难加成、能氧化,则苯的燃烧反应为氧化反应,故C错误;
D.Cu与氯化铁反应生成氯化亚铁、氯化铜,不发生金属单质的置换反应,不能说明Cu的金属活动性大于Fe,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、制备实验、发生的反应等为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中有3个C-C键和3个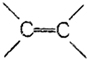 键 键 | |
| B. | 苯分子中的碳碳键是一种介于C-C键和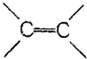 键之间的特殊的键 键之间的特殊的键 | |
| C. | 苯分子中的6个碳碳键不是完全相同的 | |
| D. | 苯分子具有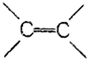 键可以使溴水褪色 键可以使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X>W | |
| B. | Z单质在过量的X单质中燃烧生成ZX3 | |
| C. | 元素Y和W能形成离子化合物 | |
| D. | 元素W、X各自最高和最低化合价的代数和分别为0、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
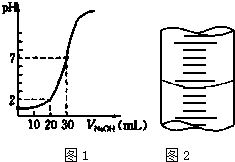 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-Cl | C-Br |
| 键能9kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com