
 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)?SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示.则正确的结论是( )
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)?SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示.则正确的结论是( )| A. | 逆反应速率:a点大于点c | |
| B. | 反应物浓度:a点小于点b | |
| C. | 反应在c点时SO2的转化率最大 | |
| D. | 反应物的总能量低于生成物的总能量 |
分析 向绝热恒容密闭容器中通入SO2和NO2,由a到c变化过程中,正反应速率增大,反应过程中反应物浓度减小,正反应速率应该减小,实质上反应速率增大,且该容器是绝热恒容容器,应该是温度对反应速率影响大于浓度对反应速率影响,则该反应的正反应是放热反应,随着温度的升高,反应速率增大,c点反应速率最大;
c点后反应速率降低,说明温度变化影响大于浓度变化影响导致反应速率降低,据此分析解答.
解答 解:反应开始反应物浓度最大,但反应速率逐渐增大,说明反应为放热反应,
A.反应放热,温度升高,正逆反应速率都增大,c温度较a时高,则逆反应速率:a点小于点c,故A错误;
B.反应向正反应进行,随着反应的进行,反应物浓度逐渐降低,故B错误;
C.c点之后正反应速率下降,是因为逆反应占据优势,吸热导致温度下降造成的,所以在c点时二氧化硫的转化率最高,故C正确;
D.正反应放热,则反应物总能量大于生成物总能量,故D错误;
故选C.
点评 本题考查图象分析,为高频考点,明确曲线变化趋势及其影响因素是解本题关键,注意题干中关键词“绝热、恒容”,说明反应过程中温度发生变化,为易错题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO).c(S{O}_{3})}{c(N{O}_{2}).c(S{O}_{2})}$的值及SO2转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
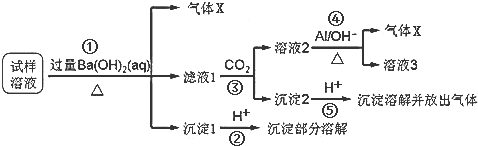
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 葡萄糖能发生氧化反应和银镜反应 | |
| C. | 乙醇和乙酸都能与氢氧化钠反应 | |
| D. | 糖类、油脂和蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应和分解反应一定是氧化还原反应 | |
| B. | CO2+H2O=H2CO3 是化合反应但不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应,复分解反应不可能属于氧化还原反应 | |
| D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 不是置换反应但是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com