
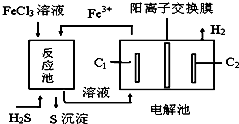
| A. | 电解池中惰性电极C1为阳极 | |
| B. | 该工艺优点之一是FeCl3溶液可循环利用 | |
| C. | 反应池中的离子方程式:2Fe3++S2-=2Fe2++S↓ | |
| D. | 电解池总反应的化学方程式:2FeCl2+2HCl$\frac{\underline{\;通电\;}}{\;}$2FeCl3+H2↑ |
分析 A.电解池中C2上得电子生成氢气,为阴极,则C1为阳极;
B.氯化铁和硫化氢发生氧化还原反应生成S和亚铁离子,亚铁离子在电解池中发生氧化反应生成铁离子;
C.硫化氢是弱电解质,写化学式;
D.电解池电解盐酸、氯化亚铁混合溶液得到氯化铁和氢气.
解答 解:A.电解池中C2上得电子发生还原反应生成氢气,则为阴极,所以C1为阳极,失电子发生氧化反应,故A正确;
B.氯化铁和硫化氢发生氧化还原反应生成S和亚铁离子,亚铁离子在电解池中发生氧化反应生成铁离子,所以FeCl3溶液可循环利用,故B正确;
C.硫化氢是弱电解质,写化学式,离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,故C错误;
D.电解池电解盐酸、氯化亚铁混合溶液得到氯化铁和氢气,电池反应式为:2FeCl2+2HCl$\frac{\underline{\;通电\;}}{\;}$2FeCl3+H2↑,故D正确;
故选C.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应、反应池中发生的反应是解本题关键,涉及离子方程式书写、电极反应式书写、电极判断等知识点,注意铁离子和硫化氢之间的氧化还原反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锅炉水垢用饱和纯碱溶液浸泡,即可除去 | |
| B. | 向淀粉水解后的溶液中滴加碘水,即可检验淀粉是否水解完全 | |
| C. | 向C2H5X消去反应后的溶液中滴加硝酸银溶液,即可检验卤原子X的种类 | |
| D. | 将25 g CuSO4•5H2O溶于100 mL水中,可配得100 mL1.0 mol/L CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期饮用纯净水,有可能引起一些微量元素缺乏症 | |
| B. | 明矾既能沉降水中的悬浮物,又能杀菌消毒 | |
| C. | 合成洗涤剂和纯碱溶液都可洗去油污,二者去污原理相同 | |
| D. | 纤维素被食用进入人体内,在酶的作用下最终水解为葡萄糖为人体提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
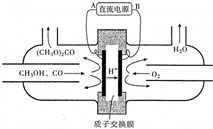 (1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺(CH3)2NH.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-).
(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺(CH3)2NH.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
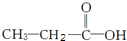 和
和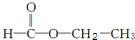 两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.
两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.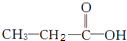 ,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰.
,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰. ,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.
,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
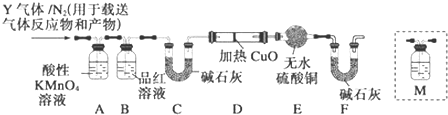
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com