
【题目】有关电化学示意图如下。回答下列问题:
(1)图中正极的电极反应是______;当Zn片的质量减少0.65g时,外电路中有_____mol电子通过。

(2)预测图中U型管的实验现象是______;结合化学用语解释产生现象的原因____。

(3)用石墨电极电解滴加紫色石蕊溶液的稀Na2SO4溶液,通电后A、B两极均有无色气体生成,装置如图所示:

①NaOH在______极生成(填“A”或“B”)。
②B极发生反应的类型为______反应(填“氧化”或“还原”)。
【答案】Cu2++2e-=Cu 0.02 左边液面上升,右边液面下降 试管中的铁钉发生吸氧腐蚀,正极反应为O2+2H2O+4e-=4OH-,O2减少而使试管中的压强小于大气压 A 氧化
【解析】
结合原电池原理分析电极反应,并计算转移电子的物质的量;根据金属的吸氧腐蚀分析;根据电解原理分析电解产物。
(1)图中Zn为负极,发生的电极反应为Zn-2e-=Zn2+,Cu为正极,发生的电极反应为Cu2++2e-=Cu,0.65g Zn的物质的量为![]() =0.01mol,则外电路中有0.02mol电子通过;
=0.01mol,则外电路中有0.02mol电子通过;
(2)铁钉发生吸氧腐蚀,正极反应式为O2+4e-+2H2O=4OH-,则试管中O2减少而使试管中的压强小于大气压,导致U型管内左边液面上升,右边液面下降;
(3)A为电解池的阴极,发生电极反应为2H++2e-=H2↑,B为阳极,发生电极反应为4OH-4e-=O2↑+2H2O;
①A极H+被还原生成H2,促进水的电离,A极周围OH-增大,则NaOH在A极生成;
②B极为阳极,发生反应的类型为氧化反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有效去除NO是环境治理的重大课题。回答下列问题:
(1)NaClO2氧化去除NO
已知:5 NaClO2(aq)+4HCl(aq)=4ClO2(g)+2H2O(l)+5NaCl(aq) △H1
5NO(g)+3ClO2(g)+4H2O(l)=5HNO3(aq)+3HCl(aq) △H2
则反应4NO(g)+3NaClO2(aq)+2H2O(l)=4HNO3(aq)+3NaCl(aq)
△H=_____(用含△H1、△H2的代数式表示)
(2)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为NO2﹣+S2O82﹣+2OH﹣NO3﹣+2SO42﹣+H2O。
不同温度下,平衡时NO2﹣的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图所示。
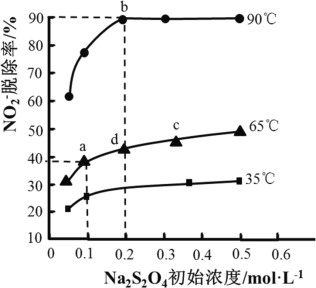
①平衡时b、d两点的浓度:c(S2O82﹣)b_____c(S2O82﹣)d(填“>”、“<”或“=”)
②a、b、c三点平衡常数K由大到小的顺序为_____,原因是_____。
③常温下,反应中NO2﹣、S2O82﹣的初始浓度均为 x molL﹣1,反应达平衡时溶液pH=14,NO3﹣浓度为 y molL﹣1(忽略反应前后溶液体积的变化),该反应的化学平衡常数为_____。
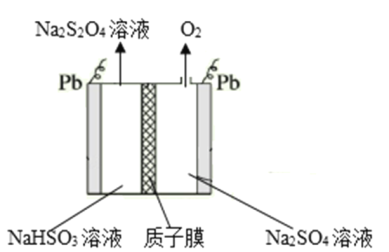
(3)连二亚硫酸钠(Na2S2O4)还原去除NO。若用连二亚硫酸钠(Na2S2O4)溶液还原NO去除污染,再电解生成的NaHSO3,可再生Na2S2O4,其电解过程如图所示,质子膜允许H+和H2O通过。阴极的电极反应式为_____,将处理 n molNO后的溶液电解至恰好完全再生时,理论上生成的O2在标准状况下的体积为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅或多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。请回答下列问题:
(1)基态硒原子的价电子排布式为___;H2O的沸点高于H2Se的沸点(-42℃),其原因是___。
(2)已知GaCl3晶体熔点为77.9℃,沸点为201.3℃,GaCl3品体类型为____。
(3)Na3AsO4中阴离子的空间构型为_____,As原子采取_____杂化。
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:_____。
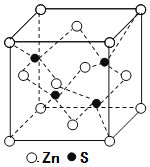
(5)锌与铜位于同一周期。硫化锌的晶胞结构如图所示,S2-周围等距离且最近的Zn2+个数为____;若晶胞边长为dpm,则硫化锌的密度为____g·cm-3(不必简化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________,基态铁原子的价电子排布图为_______
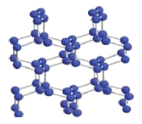
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。
(3)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
①写出与N3-属于等电子体的一种分子__________(填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数为______nm(用含d和NA的代数式表示)。
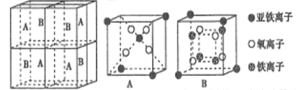
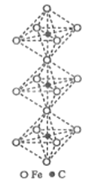
(5)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A | B | C | D | |
反应装置或图象 |
|
|
|
|
实验现象或图象信息 | 温度计的水银柱上升 | 反应物总能量大于生成物总能量 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲处液面低于乙处液面 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容不正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
原理 | 牺牲阳极的阴极保护法 | 电镀 | 电解CuCl2溶液 | 氢氧燃料电池 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓缓通过无水CaCl2时,CaCl2的质量增加22.5 g。原混合气体中CO2的质量为( )
A.13.2 gB.26.4 gC.19.7 gD.24.4 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com