
| A. | 要用到的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管和容量瓶 | |
| B. | 量取浓硫酸的体积为24 mL | |
| C. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,不断搅拌并冷却至室温 | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容 |
分析 A.依据配制步骤选择需要的仪器;
B.依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,结合溶液稀释规律计算需要浓硫酸体积;
C.依据浓硫酸稀释的正确操作解答;
D.容量瓶为精密仪器不能用来溶解固体,稀释浓溶液.
解答 解:A.用浓硫酸配制稀硫酸溶液,步骤为:计算、量取、稀释、移液、洗涤、定容等,用到的仪器:玻璃棒、烧杯、量筒、胶头滴管和容量瓶,故A正确;
B.质量分数为98%的浓硫酸(ρ=1.84g•cm-3)物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,则配制240mL1.84mol•L-1的稀硫酸,应选择250mL容量瓶,设需要浓硫酸体积为V,则V×18.4mol/L=250mL×1.84mol/L,解得V=25.0mL,故B错误;
C.浓硫酸稀释应将浓硫酸沿着烧杯壁缓缓注入水中,同时不断用玻璃棒搅拌,故C错误;
D.容量瓶为精密仪器,不能用来稀释浓硫酸,故D错误;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意容量瓶规格的选择及容量瓶使用注意事项.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸 NaCl+MnO2 AgNO3 | B. | NaOH溶液 Ca(HCO3)2 Ca(OH)2 | ||
| C. | NaOH溶液 (NH4)2SO4 KAl(SO4)2 | D. | 浓硫酸 NaCl H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水导电能力比BaSO4的水溶液强,所以氨水是强电解质,BaSO4是弱电解质 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 若反应C(s)+CO2(g)?2CO(g)在常温下不能自发,则该反应的△H>0 | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
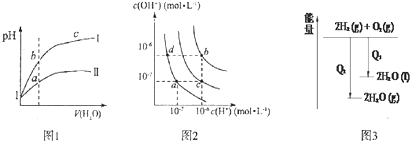
| A. | 图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 | |
| D. | 图3表示氢气与氧气反应中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在X点时,由H2O电离出的c(H+)相等,c(M+)=c(R+) | |
| B. | 稀释前,c(ROH)=10c(MOH) | |
| C. | 稀释前的ROH与等体积pH=1的H2SO4混合后所得溶液显酸性 | |
| D. | 等体积等浓度的MOH和HCl混合后,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气反应生成一氯甲烷 | B. | 苯与氢气反应生成环己烷 | ||
| C. | 乙烯与溴反应生成1,2-二溴乙烷 | D. | 乙醇与氧气反应生成乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
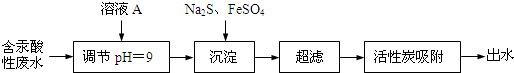
| 离子 | Na+ | Fe2+ | Cl- | SO42- |
| 浓度(mol/L) | 3.0×10-4 | 2.0×10-4 | 2.5×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
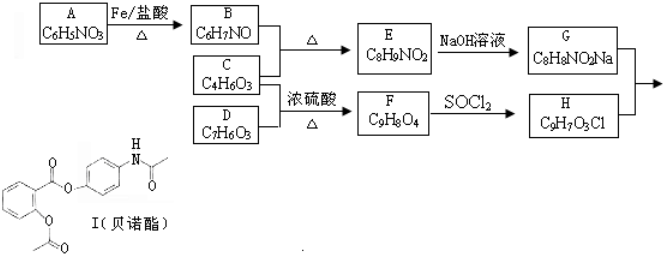
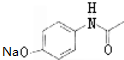 .
. (其中的三种).
(其中的三种). 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件).示例:CH4$→_{光照}^{2Cl}$CH3Cl$→_{△}^{NaOH溶液}$CH3OH.
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件).示例:CH4$→_{光照}^{2Cl}$CH3Cl$→_{△}^{NaOH溶液}$CH3OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com