
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
分析 (1)已知反应 CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=a kJ/mol ①
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(l)△H2 ②
根据盖斯定律可知,将$\frac{①-②}{2}$计算得到;
(2)①20min-30min反应达到平衡,图表中平衡浓度,依据平衡常数的概念计算得到K=$\frac{c(C{O}_{2})c({N}_{2})}{{c}^{2}(NO)}$;
②依据图表数据变化分析,30min末一氧化氮和二氧化碳浓度减小,氮气浓度增大,结合计算平衡常数和浓度变化分析判断;改变的条件可能是减小二氧化碳浓度;
③根据浓度比值的变化来确定移动方向.
解答 解:(1)已知反应 CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=a kJ/mol ①
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(l)△H2 ②
根据盖斯定律可知,将$\frac{①-②}{2}$可得:
N2(g)+O2(g)═2NO(g)△H3=$\frac{△{H}_{1}-△{H}_{2}}{2}$=bkJ/mol
而△H1=a kJ/mol,故可解得△H2=( a-2b)kJ/mol,
故答案为:N2(g)+O2(g)═2NO(g)△H3=bkJ/mol;a-2b;
(2)20-30min反应达到平衡状态,C(s)+2NO(g)?N2 (g)+CO2 (g),各物质的平衡浓度为:c(CO2)=c(N2)=0.3mol/L、c(NO)=0.4mol/L,反应的平衡常数为:K=$\frac{c(C{O}_{2})c({N}_{2})}{{c}^{2}(NO)}$=$\frac{0.3×0.3}{0.{4}^{2}}$=0.56,故答案为:0.56;
②30min时改变某一条件,反应重新达到平衡时c(N2)=0.34mol/L;c(CO2)=0.17mol/L;c(NO)=0.32mol/L;则平衡常数K=$\frac{c(C{O}_{2})c({N}_{2})}{{c}^{2}(NO)}$=$\frac{0.34×0.17}{0.3{2}^{2}}$=0.56,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以减小二氧化碳浓度,平衡正向进行的结果,
故答案为:减小二氧化碳浓度;
③30min时,容器中NO、N2、CO2的浓度之比=0.040:0.030:0.030=4:3:3,30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则平衡向逆反应方向移动,所以逆反应是吸热反应,正反应是放热反应,则△H<0,
故答案为:<.
点评 本题考查了化学平衡常数、化学平衡移动的影响因素等,侧重考查学生对数据的分析处理,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 对于任何化学反应,增大压强均可使单位体积内活化分子数增多,反应速率加快 | |
| C. | 加入反应物,可增加活化分子百分数,从而增大化学反应速率 | |
| D. | 某反应的△H=100kJ•mol-1,说明正反应活化能比逆反应活化能大100kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 储热材料是一类重要的存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量 | |
| B. | Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池 | |
| C. | Ba2+浓度较高时危害健康,但BaSO4可服入体内,作为造影剂用于X-射线检查肠胃道疾病 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+,Cu2+,Cd2+,Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为10的氧原子:${\;}_8^{10}O$ | B. | Mg2+的结构示意图: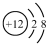 | ||
| C. | 硫化钠的电子式: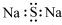 | D. | 甲酸甲酯的结构简式:C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO溶液和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳可与氢气在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,这些措施符合低碳经济的发展要求 | |
| B. | 石油分馏、海水晒盐、燃煤烟气的脱硫、菜籽中提取菜籽油等过程都是物理变化 | |
| C. | 利用电解原理可制备Na、Mg、Al等活泼金属,也可实现N2和H2合成NH3 | |
| D. | 研究发现出土的青铜器表面若有白色的CuCl,会加快青铜器的腐蚀速率,这是因为CuCl作为催化剂降低了腐蚀反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打溶液与稀盐酸混合:HCO3-+H+═CO2↑+H2O | |
| B. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-═NH3•H2O+BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
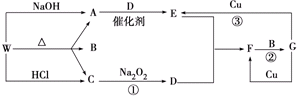
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 解释 |
| A | 向新制氯水中滴加紫色石蕊试液 | 溶液变为红色且保持不变 | 新制氯水具有酸性 |
| B | SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 符合复分解反应发生条件 |
| C | 无色溶液中滴加FeCl3溶液和CCl4,振荡、静置 | 下层显紫色 | 原溶液中含有I- |
| D | 将少量酸性高锰酸钾溶液滴入乙酸溶液中 | 溶液仍为无色 | 高锰酸钾发生还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com