
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 硫化氢气体通入氯化亚铁溶液:S2-+Fe2+═FeS↓ | |
| C. | 将氯气通入氯化亚铁溶液:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ |
分析 A.2mol钠完全反应生成1mol氢气,该反应违反了电子守恒、电荷守恒;
B.硫化亚铁溶于强酸,二者不发生反应;
C.氯气将亚铁离子氧化成铁离子;
D.2mol铝与氢氧化钠溶液完全反应生成3mol氢气.
解答 解:A.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.硫化氢气体通入氯化亚铁溶液,二者不发生反应,故B错误;
C.将氯气通入氯化亚铁溶液,反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D.铝溶于氢氧化钠溶液生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-═2AlO2-+3H2↑,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:解答题
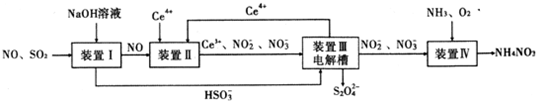
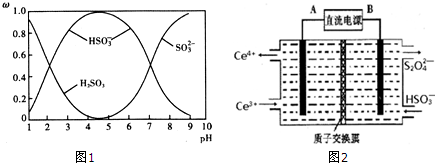
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
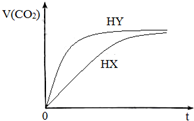 25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol/LHX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 用等浓度的两种酸恰好中和等浓度等体积的氢氧化钠溶液,前者所用的体积大于后者 | |
| B. | pH值相同的HX和HY溶液中水的电离程度:HX>HY | |
| C. | 相同体积相同浓度的NaX和NaY溶液中阴离子数目前者大于后者 | |
| D. | 向10mL 0.1mol/L的Na2CO3溶液中缓慢滴加10mL0.1mol/L的HY,混合后的离子浓度大小关系:c (Na+)>c (Y-)>c (HCO3-)>c (OH-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使多糖水解 | B. | 使油脂水解 | C. | 使氨基酸变性 | D. | 使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
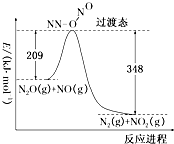
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com