
科目:高中化学 来源:不详 题型:填空题
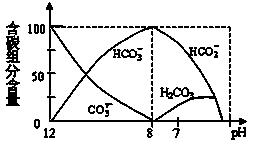
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
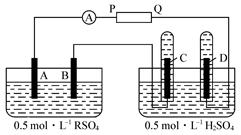
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阴极的电极反应式为Cu2++2e-====Cu,当有Cu2+时,Fe3+不放电 |
| B.阴极上首先析出铁,然后析出铜 |
| C.首先被电解的是Fe2(SO4)3溶液,后被电解的是CuSO4溶液 |
| D.阴极上不可能析出铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

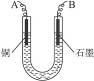
| A.称量电解前电极的质量 |
| B.电解后电极在烘干、称量前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上的铜,并清洗、称量 |
| D.电极在烘干称量的操作必须按烘干→称量→再烘干→再称量进行两次 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁腐蚀的速度由大到小的顺序是:只接通K1>只 闭合K3>都断开>只闭合K2 |
| B.只接通K1,一段时间后,U形管中出现白色沉淀 |
| C.只接通K2,U形管左、右两端液面均下降 |
| D.先只接通K1,一段时间后,漏斗液面上升,然后再 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com