

| A. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 | |
| B. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ |
分析 在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,则A只能是NO,说明溶液中含有还原性离子,则一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀F只为Fe(OH)3,生成气体D,则D为NH3,说明溶液中含有NH4+离子;溶液E中通入CO2气体,生成沉淀H,则H为Al(OH)3,E为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子和SO32-离子,那么一定含有SO42-离子,那么就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答.
解答 解:依据分析可知,溶液中一定存在:NH4+、Al3+、Fe2+、SO42-,一定不含有:Ba2+、CO32-、SO32-、NO3-,不能确定是否含有:Fe3+和Cl-,
A.生成气体A的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的气体A为112 mL,物质的量为:$\frac{0.112L}{22.4L/mol}$=0.005mol,故n(Fe2+)=3×0.005=0.015mol,c(Fe2+)=$\frac{0.015mol}{0.1L}$=0.15mol/L,故A错误;
B.根据上述分析可知H为Al(OH)3,BaCO3与过量的二氧化碳生成碳酸氢钡,易溶于水,故B错误;
C.依据分析可知,溶液中一定存在:NH4+、Al3+、Fe2+、SO42-,不能确定Cl-是否存在,故C错误;
D.由分析可知,上述连续实验不能确定溶液X中是否含有Fe3+,故D正确.
故选D.
点评 本题考查了常见离子的检验、无机推断,题目难度中等,注意掌握常见离子的性质及检验方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题

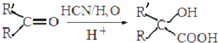
 生成
生成 的反应类型是取代反应.
的反应类型是取代反应. .
. .
.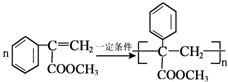 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O所含的电子数目为9N0 | |
| B. | 0.1 mol/L Na2SO4溶液所含Na+数目为0.2N0 | |
| C. | 1 mol钠完全反应时所失去的电子数为N0 | |
| D. | 标准状况下22.4L O2所含的原子数目为N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| I | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| II | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| III | 900 | 2 | 1 | a | b | t |
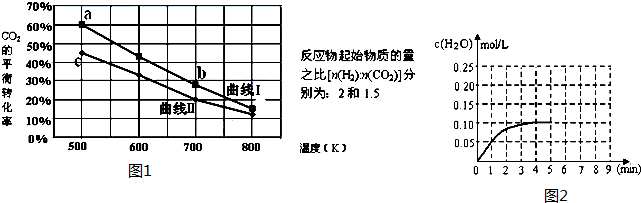
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
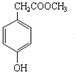 的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气.
的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| B. | 60gSiO2中含有NA个SiO2分子 | |
| C. | 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA | |
| D. | 1molFe与1mol氯气反应转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液可用于刻制印刷铜电路板 | |
| B. | Na2O2常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 二氧化硅可做半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处
冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处 所代表的微粒为( )
所代表的微粒为( )| A. | Na+ | B. | Al3+ | C. | F- | D. | AlF${\;}_{6}^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com