
分析 根据n=$\frac{V}{{V}_{m}}$计算二氧化硫气体的物质的量,根据方程式Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O计算参加反应Cu的铜的物质的量和质量,由此分析解答.
解答 解:标准化状况下,2.24L二氧化硫的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
令参加反应的Cu的质量为m,则:
Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O
64g 1mol
m 0.1mol
所以m=64g×$\frac{0.1mol}{1mol}$=6.4g,n=$\frac{m}{M}$=$\frac{6.4g}{64g/mol}$=0.1mol,
答:参加反应Cu的铜的物质的量和质量分别为:0.1mol、6.4g.
点评 本题考查根据方程式的有关计算、氧化还原反应等,比较基础,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
| 二氧化氯消毒液1000mL | |
| 溶质的质量分数 | 80% |
| 密度 | 1.2g/cm3 |
| 强腐蚀性,阴冷,密封储存 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=V2=V3 | B. | V1>V3>V2 | C. | V2>V3>V1 | D. | V1>V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
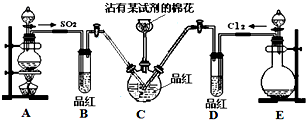 探究SO2和氯水的漂白性,设计了如下实验,装置如图.
探究SO2和氯水的漂白性,设计了如下实验,装置如图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
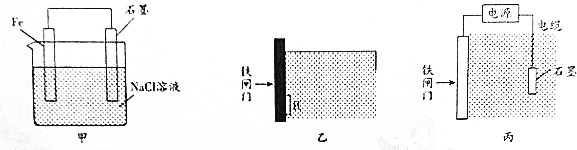
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
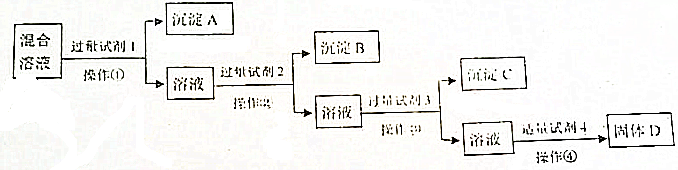
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | pH=7 | pH=6 | pH=5 | pH=3 |
| 20℃ | 300 | 240 | 160 | 58 |
| 30℃ | 160 | 108 | 40 | 20 |
| 50℃ | 80 | 50 | x | 8 |
| A. | x可能为42 | |
| B. | 其他条件不变,在30°、pH=4下的反应速度比40℃、pH=6时快 | |
| C. | 根据单一变量法,无法比较温度、pH均不同的两组实验的反应速率较慢 | |
| D. | 30℃,pH=3条件下,KI的反应速率为v(KI)=0.005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol CO2和CO混合气体含有的碳原子数为NA | |
| B. | 在KIO3+6HI═KI+3I2+3H2O反应中,每生成 3molI2,则转移6NA个电子 | |
| C. | 78gNa2O2与足量的CO2完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol-L-1 Na2S溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com