
����Ŀ��I.�ö��Ե缫���400 mLһ��Ũ�ȵ�CuSO4��Һ(�����ǵ���������Һ����ı仯)��ͨ��һ��ʱ�����
������������Һ�м���0.1molCuO��,ʹ��Һǡ�ûָ������ǰ��Ũ�Ⱥ�pH,���������ܵ����ӷ�Ӧ����ʽΪ_________��
���������õ���Һ�м���0.1 mol Cu2(OH)2CO3��ʹ��Һǡ�ûָ������ǰ��Ũ�Ⱥ�pH����������ת�Ƶĵ���Ϊ__________mol��
II.�����ʵ�����Ϊ0.1mol��AlCl3��CuCl2��H2SO4����ˮ�Ƴ�100mL�Ļ����Һ����ʯī���缫��⣬���ռ����缫�����������壬һ��ʱ����������ռ�������������ͬ�����������ͬ�����·�й�ת��____________mol���ӣ���ʱ��Ԫ����_____________��ʽ���ڡ�(�û�ѧ��������)
III.��ⷨ��������������������ɻ������ᣬ���нϸߵĻ���Ч��;���Ч�档ʵ����ģ���ⷨ����NOx��װ����ͼ��ʾ(ͼ�е缫��Ϊʯī�缫)��
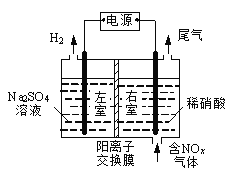
(1) ����NO2�������ģ���ⷨ����ʵ�顣
�� д�����ʱNO2������Ӧ�ĵ缫��Ӧʽ��__________________��
�� ���б�״����2.24 LNO2�����գ�ͨ�������ӽ���Ĥ(ֻ����������ͨ��)��H��________mol��
(2) ijС��������װ��10 L 0.2 mol��L-1���ᣬ�ú�NO��NO2(������NO2ת��ΪN2O4)�ķ�������ģ���ⷨ����ʵ�顣�������У��в���NOת��ΪHNO2��ʵ�����ʱ�����������Һ�к�3 mol HNO3��0.1 mol HNO2��ͬʱ�����ռ�����״����28 LH2��ԭ������NO��NO2�������_____________��
���𰸡�
I.��2Cu2++2H2O![]() 2Cu+O2��+4H+����0.6
2Cu+O2��+4H+����0.6
II.0.9��Al(OH)3��Al3+
III.(1)��NO2-e-��H2O=NO3-��2H+����0.1��(2)8��3
��������
���������I. ������Ϣ��֪����ⷢ��2H2O+2CuSO4![]() 2Cu+O2��+2H2SO4 ����������Һ�м���0.1mol CuO��ַ�Ӧ����Һǡ�ûָ������ǰ��״̬������������0.1molCu�����������ܵ����ӷ�Ӧ����ʽΪ2Cu2++2H2O
2Cu+O2��+2H2SO4 ����������Һ�м���0.1mol CuO��ַ�Ӧ����Һǡ�ûָ������ǰ��״̬������������0.1molCu�����������ܵ����ӷ�Ӧ����ʽΪ2Cu2++2H2O![]() 2Cu+O2��+4H+���ʴ�Ϊ��2Cu2++2H2O
2Cu+O2��+4H+���ʴ�Ϊ��2Cu2++2H2O![]() 2Cu+O2��+4H+��
2Cu+O2��+4H+��
���������ͭ��Һ����Һ�����ԣ���������Һ�м����ʽ̼��ͭ�ָܻ�ԭ��Һ����ʽ̼��ͭ�����ᷴӦ��������ͭ��ˮ�Ͷ�����̼����Һ�������ӵ�����ͭ�����������ӣ�����ʵ���ϵ������ͭ��Һ�������Σ���һ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4���ڶ��Σ�2H2O
2Cu+O2��+2H2SO4���ڶ��Σ�2H2O![]() 2H2��+O2��������ʽ̼��ͭ��ѧʽ�ı�Ϊ2CuOH2OCO2�����Լ���0.1molCu2(OH)2CO3 ���൱�ڼ���0.2molCuO��0.1molˮ����һ�Σ�����ͭԭ���غ�֪���������ͭ��Һ����n(Cu)=n(CuO)=0.2mol��ת�Ƶ��ӵ����ʵ���=0.2mol��2=0.4mol���ڶ��Σ��������0.1molˮת�Ƶ��ӵ����ʵ���=0.1mol��2=0.2mol�����Ե������й�ת�Ƶĵ�����Ϊ0.4mol+0.2mol=0.6mol���ʴ�Ϊ��0.6��
2H2��+O2��������ʽ̼��ͭ��ѧʽ�ı�Ϊ2CuOH2OCO2�����Լ���0.1molCu2(OH)2CO3 ���൱�ڼ���0.2molCuO��0.1molˮ����һ�Σ�����ͭԭ���غ�֪���������ͭ��Һ����n(Cu)=n(CuO)=0.2mol��ת�Ƶ��ӵ����ʵ���=0.2mol��2=0.4mol���ڶ��Σ��������0.1molˮת�Ƶ��ӵ����ʵ���=0.1mol��2=0.2mol�����Ե������й�ת�Ƶĵ�����Ϊ0.4mol+0.2mol=0.6mol���ʴ�Ϊ��0.6��
II.�����Ϸ����ĵ缫��ӦΪ��Cu2++2e-=Cu��2H++2e-=H2���������Ϸ����缫��Ӧ��Cl--2e-=Cl2����4OH-��O2��+2H2O+4e-����֪Cu2+ȫ����Ӧ��Cu2+0.1mol��Cl-��Ӧ��ȫ���������ϣ�Cu2++2e-=Cu��ͭ����ȫ���ŵ�ת�Ƶ�����0.2mol��2H++2e-=H2����(Cu2+ȫ����Ӧ��H+��ʼ��⣬����൱�ڵ��HCl)�������ϣ�Cl--e-=![]() Cl2����������ȫ���ŵ�ת�Ƶ�����0.5mol������������0.25mol��4OH--4e-=2H2O+O2����������ת�Ƶ�����x����0.25+
Cl2����������ȫ���ŵ�ת�Ƶ�����0.5mol������������0.25mol��4OH--4e-=2H2O+O2����������ת�Ƶ�����x����0.25+![]() ��(x-0.5)=
��(x-0.5)=![]() (x-0.2)�����x=0.9mol�� Al3+�����������õ缫�ϵĵ缫��Ӧ�������Ϸ����ĵ缫��ӦΪ��Cu2++2e-=Cu��2H++2e-=H2����ͭ����ȫ���ŵ�ת�Ƶ�����0.2mol��ת�Ƶ���0.9mol��������������0.7mol��ԭ��Һ�к���0.2molH+�����ĵ�OH-0.4mol���൱�ڶ����0.1molOH-��Al3+0.1mol��OH-0.1mol��������Һ����Al3+��ʽ���ڣ�����Al(OH)3����������Ԫ�ؽ��������Ӻ�Al(OH)3����ʽ���ڣ��ʴ�Ϊ��0.9��Al3+ ��Al(OH)3��
(x-0.2)�����x=0.9mol�� Al3+�����������õ缫�ϵĵ缫��Ӧ�������Ϸ����ĵ缫��ӦΪ��Cu2++2e-=Cu��2H++2e-=H2����ͭ����ȫ���ŵ�ת�Ƶ�����0.2mol��ת�Ƶ���0.9mol��������������0.7mol��ԭ��Һ�к���0.2molH+�����ĵ�OH-0.4mol���൱�ڶ����0.1molOH-��Al3+0.1mol��OH-0.1mol��������Һ����Al3+��ʽ���ڣ�����Al(OH)3����������Ԫ�ؽ��������Ӻ�Al(OH)3����ʽ���ڣ��ʴ�Ϊ��0.9��Al3+ ��Al(OH)3��
III.(1)������ͼ֪�����ʱ�������е缫�������ӷŵ�����������������Ϊ�����ң�����Ϊ�����ң�������ͨ����ǵ���������ɵ����ᣬ���������ϵ�������ʧ���Ӻ�ˮ�������ᣬ�缫��ӦʽΪ
��n(NO2)=![]() =1.25mol��0.1mol��������ӦʽΪNO2-e-+H2O=NO3-+2H+����0.2mol���������ɣ���Ϊ��0.1mol�������ɣ�����0.1mol���������������ң��ʴ�Ϊ��0.1��
=1.25mol��0.1mol��������ӦʽΪNO2-e-+H2O=NO3-+2H+����0.2mol���������ɣ���Ϊ��0.1mol�������ɣ�����0.1mol���������������ң��ʴ�Ϊ��0.1��
(2)n(H2)=![]() =1.25mol������ת�Ƶ����غ��ת�Ƶ������ʵ���=1.25mol��2=2.5mol�����ǰ��Һ��n(HNO3)=0.2mol/L��10L=2mol��������Һ�к�3mol HNO3��0.1molHNO2��˵������������1mol HNO3��0.1molHNO2���ɣ�����Nԭ���غ��n(NO)+n(NO2)=3 mol-0.2 molL-1��10 L+0.1 mol=1.1 mol������0.1mol������ת�Ƶ���0.1mol����Ҫ0.1mol���ӣ�����������ת�Ƶ������ʵ���=2.5mol-0.1mol=2.4mol����μӷ�Ӧ���������NO���ʵ���Ϊxmol���������������ʵ���Ϊymol������Nԭ���غ㼰ת�Ƶ����غ����x+y��1.10.1��3x+y��2.4�����x��0.7��y��0.3��n(NO)��n(NO2)=(0.7+0.1)mol��0.3mol=8��3����ͬ��������������֮�ȵ������ʵ���֮�ȣ�����NO�Ͷ������������֮��Ϊ8��3���ʴ�Ϊ��8��3��
=1.25mol������ת�Ƶ����غ��ת�Ƶ������ʵ���=1.25mol��2=2.5mol�����ǰ��Һ��n(HNO3)=0.2mol/L��10L=2mol��������Һ�к�3mol HNO3��0.1molHNO2��˵������������1mol HNO3��0.1molHNO2���ɣ�����Nԭ���غ��n(NO)+n(NO2)=3 mol-0.2 molL-1��10 L+0.1 mol=1.1 mol������0.1mol������ת�Ƶ���0.1mol����Ҫ0.1mol���ӣ�����������ת�Ƶ������ʵ���=2.5mol-0.1mol=2.4mol����μӷ�Ӧ���������NO���ʵ���Ϊxmol���������������ʵ���Ϊymol������Nԭ���غ㼰ת�Ƶ����غ����x+y��1.10.1��3x+y��2.4�����x��0.7��y��0.3��n(NO)��n(NO2)=(0.7+0.1)mol��0.3mol=8��3����ͬ��������������֮�ȵ������ʵ���֮�ȣ�����NO�Ͷ������������֮��Ϊ8��3���ʴ�Ϊ��8��3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������ܱ������н��еķ�Ӧ��2SO2(g) + O2(g) ![]() 2SO3(g)������˵���ܳ��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����
2SO3(g)������˵���ܳ��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����
A. �����淴Ӧ���ʶ������� B. SO2��O2��SO3��Ũ�����
C. SO2��O2��SO3�������й��� D. SO2��O2��SO3��Ũ�Ⱦ����ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
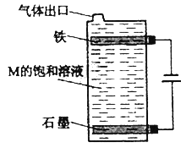
����Ŀ���ס��ҡ�����������Ϊԭ��������������Ķ�����Ԫ�ء��ס�������ͬһ���壬���������촦��ͬһ���ڣ���ԭ�ӵ������������Ǽס��ҡ���ԭ������������֮�͡��ס�����ɵij�������X��ʹʪ��ĺ�ɫʯ����ֽ��������ĵ�����X��Ӧ�������ҵĵ��ʣ�ͬʱ������������ˮ�������ԵĻ�����Y��Z,0.1 mol/L��Y��ҺpH��1�����ĵ��ʼ������Ԫ������������ˮ�������Һ��Ӧ������L��Ҳ����Z��ˮ��Һ��Ӧ�����Σ����������ɻ�����M����ش��������⣺
��1�������ӵĽṹʾ��ͼΪ________��
��2��д���ҵĵ��ʵĵ���ʽ��________��
��3����ĵ�����X��Ӧ���ɵ�Y��Z�����ʵ���֮��Ϊ2��4����Ӧ�б������������뱻��ԭ�����ʵ����ʵ���֮��Ϊ________��
��4��д������Z��ϡ��Һ�������L��ϡ��Һ�з�����Ӧ�����ӷ���ʽ��____________��
��5����ͼ���M�ı�����Һ��д���õ����з�����Ӧ���ܷ�Ӧ����ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A��AgNO3��Һ�м�������İ�ˮ��Ag����NH3��H2O��AgOH��NH4��
B��������̼������Һ��Ӧ��2CH3COOH��CO32��![]() CO2����H2O+2CH3COO��
CO2����H2O+2CH3COO��
C����������Һ��ͨ������CO2��CO2+H2O+2C6H5O��![]() 2C6H5OH+2CO32��
2C6H5OH+2CO32��
D����ͭ���缫����Ȼ�ͭ��Һ��Cu2++2Cl��![]() Cu+Cl2��
Cu+Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL0.1mol��L��1��HR��Һ����ε���0.1mol��L��1��NH3��H2O��Һ��������ҺpH�������Ա仯��ͼ�����з�����ȷ����(����)
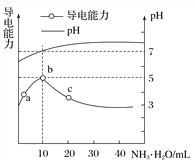
A. HRΪǿ�� B. a��b������ʾ��Һ��ˮ�ĵ���̶���ͬ
C. b����Һ��c(NH![]() )��c(R��)��c(OH��)��c(H��) D. a��c�������Һ����c(H��)��c(OH��)��Kw��1.0��10��14
)��c(R��)��c(OH��)��c(H��) D. a��c�������Һ����c(H��)��c(OH��)��Kw��1.0��10��14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�����ڱ���һ���֣�����Ԫ�آ١����ڱ��е�λ�ã����û�ѧ����ش��������⣺
���� | ��A | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
(1)�ܡ��ݡ�������Ԫ���У����Ӱ뾶��С��˳��Ϊ__>__>__�������ӷ��ţ���
(2)�ڡ��ߡ������ۺ�����������ǿ������˳����(�ѧʽ)___>__>__��
(3)������ݵ�����������ˮ���ﷴӦ�����ӷ���ʽΪ________________��
(4)��˵����ķǽ����ԱȢ�ķǽ�����________���ǿ��������������ʵ�ǣ� _________________�������ӷ���ʽ˵������
(5)�ٺ͢��γɵ�18���ӵĻ��������һ��Ӧ�ù㷺�Ļ���ԭ�ϣ�д���ĵ���ʽ___________��ʵ�����п��ô���������Һ�백��Ӧ�Ʊ��ף���Ӧ�Ļ�ѧ����ʽΪ___________________�������ڴ�����ѹ��¯ˮ�е�������ֹ��¯����ʴ��������1kg�ļɳ�ȥˮ���ܽ��O2________kg��
(6)�����£��ɢ٢����10���ӵĻ������ҿ���Ϊȼ�ϵ�ص�ԭ��֮һ����д�����ڼ��Խ����еĵ缫��Ӧʽ��������____________________������_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ����У�����������Դ��һ���ǣ�
����Ȼ������ú���ۺ��ܣ���ʯ�ͣ���̫���ܣ����������ܣ��߷��ܣ�������
A. �٢ڢۢ� B. �٢ݢޢߢ� C. �ۢܢޢ� D. �ۢݢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ�������Թܱ��ϻ�մ��MnO2����������������Լ���ȥ
A. �ȵ�Ũ���� B. ϡ���� C. ˮ D. NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦC(s)+H2OCO(g)+H2(g)��H��0���ﵽƽ��ʱ������˵����ȷ����
A. ���������ƽ�ⳣ������
B. ��С��������������淴Ӧ���ʾ���С
C. ����C������H2O��ת��������
D. �����¶ȣ�ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com