
 CO+3H2.
CO+3H2.分析 (1)合成氨中,氮气和氢气在合成塔中反应生成氨气,氮气、氧气都为分子晶体,氮气2小于氧气,所以分离空气提取氮气的方法为先液化、后汽化或蒸馏,先汽化的气体为氮气,以此提取氮气,水蒸气和甲烷反应生成一氧化碳和氢气,据此书写方程式;
(2)工业上在合成氨的过程中,为防止催化剂中毒,必须对原料进行净化;
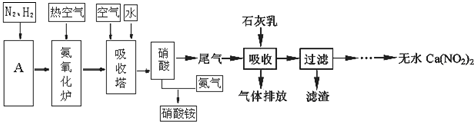
(3)①使尾气中NO、NO2与石灰乳充分接触;滤渣的主要成分是Ca(OH)2;
②若n(NO):n(NO2)>1:1,则一氧化氮过量,若<1:1,则二氧化氮过量;
(4)根据氮原子守恒可知,NH3~NO~HNO3,以此计算.
解答 解:(1)工业合成氨的原料是N2和H2,合成氨的设备依次有:压缩机、合成塔、冷凝器、氨分离器、循环压缩机,装置A为合成塔,在其中为压缩的氮气和氢气反应生成氨气,反应原料N2可从空气中分离出来,方法是先将空气液化,然后蒸馏或控制N2的沸点加热蒸发,氮气先汽化,即可得到,水蒸气和甲烷反应生成一氧化碳和氢气,反应为:CH4+H2O(g)  CO+3H2,
CO+3H2,
故答案为:合成塔;液化;蒸馏或控制N2的沸点加热蒸发;CH4+H2O(g)  CO+3H2;
CO+3H2;
(2)工业上在合成氨的过程中,必须对原料进行净化,防止催化剂铁触媒中毒,而减小催化活性,
故答案为:防止催化剂中毒;
(3)①使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;滤渣主要成分是Ca(OH)2,
故答案为:使尾气中NO、NO2被充分吸收;Ca(OH)2;
②若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高;若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,
故答案为:排放气体中NO含量升高;产品Ca(NO2)2中Ca(NO3)2含量升高;
(4)由NH3制NO的产率是95%、NO制HNO3的产率是90%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×95%×90%=0.855mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.855mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为 $\frac{1mol}{1mol+0.855mol}$×100%=53.9%;即制HNO3所用去的NH3的质量占总耗NH3质量的53.9%,
故答案为:53.9.
点评 本题通过合成上氨及氨氧化法制硝酸为载体,考查学生在“工艺流程阅读分析,化学反应原理在工艺流程的应用,氧化还原反应分析,相关反应的书写”等方面,考查学生对新信息的处理能力,注意对元素化合物性质及其转化关系的理解和应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图:
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图: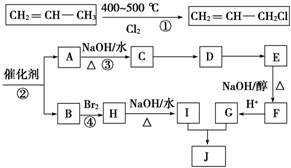
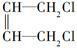 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$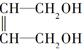 +2NaCl.
+2NaCl. ,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).
,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可用新制的氢氧化铜悬浊液检验 | |
| B. | 实验室由Y和M制取乙酸乙酯时可用饱和Na2CO3溶液来提纯 | |
| C. | 乙酸乙酯的同分异构体中含有“-COO-”结构的还有3种 | |
| D. | Y分子中含有3种不同环境的氢,峰面积比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
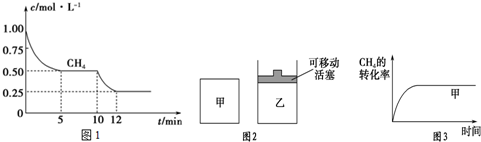
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子离核越近,能量越高 | |
| B. | 原子核外电子的运动没有规律 | |
| C. | 在多电子原子中,核外电子分层排布 | |
| D. | 电子一般尽可能排布在能量高的电子层中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题


| A. | 反应①、③的原子利用率均为100% | |
| B. | 两种流程最终分离HCOOH都用洗涤液分液法 | |
| C. | 从原料充分利用角度看,流程二比流程一更优 | |
| D. | 两种流程总反应均为CO+H2O→HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(S04)3溶液中加入过量氨水:A3++4NH3•H2O═AlO-+4NH4++2H2O | |
| B. | 少量双氧水滴人酸性KI溶液:2H202+2I-═2H++4H20+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-═3Fe3++NO+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一═2MnOOH+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com