
 HSO3-+OH-(HSO3-+H2O
HSO3-+OH-(HSO3-+H2O H2SO3+OH-)(写对第一级即可)
H2SO3+OH-)(写对第一级即可)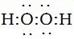 H2O2
H2O2 HO2-+H+
HO2-+H+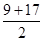 =13,推出A肯定是H元素,由于原子序数b>c,则B元素肯定为Na元素,则有1+11=(c+c+8)/2,解得c=8,即C为O元素,D为S元素,再根据C、E相邻,B、F也相邻及原子序数大小确定E为N元素,F为Mg元素。
=13,推出A肯定是H元素,由于原子序数b>c,则B元素肯定为Na元素,则有1+11=(c+c+8)/2,解得c=8,即C为O元素,D为S元素,再根据C、E相邻,B、F也相邻及原子序数大小确定E为N元素,F为Mg元素。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:不详 题型:单选题
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+ + + =BaCO3↓+NH3·H2O+H2O =BaCO3↓+NH3·H2O+H2O |
| B.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O |
C.向亚硫酸钠溶液中加入足量硝酸: +2H+=SO2↑+H2O +2H+=SO2↑+H2O |
D.向AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
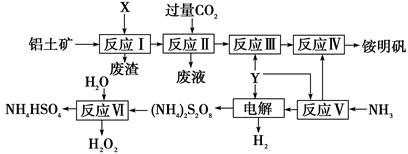
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 操作方法 | 主要现象 | 化学方程式或离子方程式 | 反应 类型 |
| A | 氢气在氯气中燃烧 | 蓝色 火焰 | H2+Cl2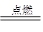 2HCl 2HCl | 化合 反应 |
| B | SO2通入硝酸 钡溶液中 | 产生白色沉淀 | Ba(NO3)2+SO2+H2O= BaSO3↓+2HNO3 | 复分解反应 |
| C | 常温下,足量 的Cl2通入 FeBr2溶液中 | 浅绿色变黄色 | 2Fe2++Cl2=2Fe3++2Cl- | 氧化还原反应 |
| D | 硫化氢通 入碘水中 | 颜色变浅产生 淡黄色固体 | H2S+I2=S↓+2HI | 氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
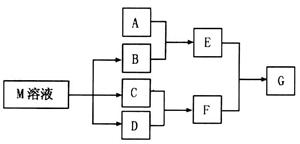
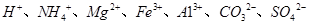 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为 。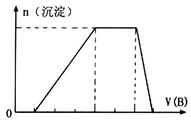
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 内容 | 评价 |
| A | 一定条件下0.5mol N2和1.5molH2反应,平衡时放热akJ,则N2(g)+3H2(g)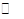 2NH3(g) 2NH3(g) 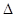 H=2akJ·mol-1 H=2akJ·mol-1 | 正确 |
| B | 氯化镁溶液与氨水反应: Mg2++2OH-=Mg(OH)2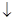 | 错误,氨水不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-=BaSO4 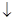 | 正确 |
| D | 等物质的量的Cl2与FeBr2在溶液中反应: 2Fe2++2Br-+2C12==2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为l:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸氢镁溶液中加入过量的NaOH溶液:Mg2++2HCO3-十4OH一=Mg(OH)2 ↓2H2O+2CO32— |
| B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
C.少量C12通入水中:Cl2 +H2O 2H++C1O-十C1- 2H++C1O-十C1- |
| D.酸性高锰酸钾可使草酸溶液褪色:2MnO4-+5C2O42-+16H+= 2Mn2++ l0CO2 ↑+8H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.硫化钠的水解反应:S2—+2H2O H2S+2OH- H2S+2OH- |
B.硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2 2Fe3++2H2O 2Fe3++2H2O |
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO32—+OH- CO32—+H2O CO32—+H2O |
D.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH- Na2SiO3↓+H2O Na2SiO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com