
| A. | 常温下硅性质活泼,可以与氯气、强酸、强碱溶液等起反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
分析 A、常温下硅化学性质稳定,常温下除与F2、HF、强碱反应外,一般不与其它物质反应;
B、Na2O与CO2发生化合生成Na2CO3,Na2O2与CO2发生化合生成Na2CO3和氧气;
C、CO、NO、NO2都是大气污染气体,一氧化氮遇到氧气就被氧化为二氧化氮;
D、氯水显示酸性,含有的次氯酸具有漂白性.
解答 解:A、常温下硅化学性质稳定,常温下除与F2、HF、强碱反应外,一般不与其它物质反应,故A正确;
B、Na2O与CO2发生化合生成Na2CO3,Na2O2与CO2发生化合生成Na2CO3和氧气,二者与CO2反应产物不相同,故B错误;
C、CO、NO、NO2都是大气污染气体,NO在空气中不能稳定存在,故C错误;
D、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液先变红色后褪色,故D错误.
故选A.
点评 本题考查硅、钠、碳及其化合物的性质与用途等,比较基础,注意基础知识积累掌握.


科目:高中化学 来源: 题型:选择题
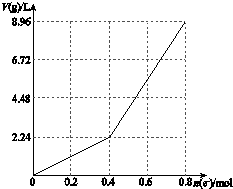 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2 mol/L | |
| B. | 电解后所得溶液中c(H+)=1 mol/L | |
| C. | 当n(e-)=0.6 mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
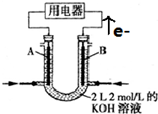
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
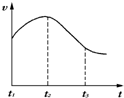 某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+被氧化 | B. | SO42-向正极移动 | C. | Cu片逐渐溶解 | D. | 溶液酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
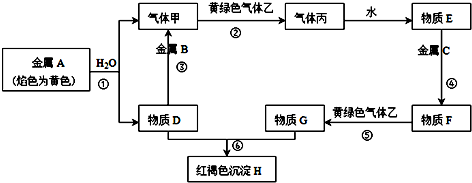
 、D
、D .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
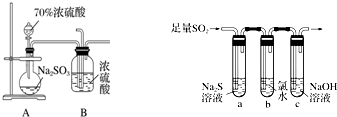
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 加入氯化钠溶液 | C. | 加入Na2CO3溶液 | D. | 加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是
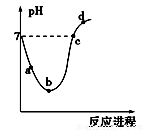
A.a点所示的溶液中[H+]=[Cl-]+[HClO]+[OH-]
B.b点所示的溶液中[H+]>[Cl-]>[HClO]>[ClO-]
C.c点所示的溶液中[Na+]=[HClO]+[ClO-]
D.d点所示的溶液中[Na+]>[ClO-]>[Cl-]>[HClO]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com