
分析 ①凡是需要对反应的温度进行控制的反应均需要用到温度计
②水浴加热的反应条件是温度控制在高于常温且低于100℃之间的温度范围内;
③对混合物液体加热时,为防止暴沸要加入碎瓷片.
解答 解:A.乙醛还原新制的氢氧化铜,需要加热至沸腾;
B.乙酸乙酯的水解需要水浴加热;
C.实验室乙醇和浓硫酸制乙烯,需要加热至170℃;
D.石油的分馏,需要温度计测定馏分的温度;
E.中和热的测定需要温度计测定反应液的温度;
F.乙醛的银镜反应,需要水浴加热,
①需要温度计的B、C、D、E、F,故答案为:B、C、D、E、F;
②需用水浴加热B、F,故答案为:B、F;
③为防止液体暴沸,常需要加入碎瓷片的是C、D,故答案为:C、D.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的制备实验及性质实验等,侧重物质的性质及实验技能的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
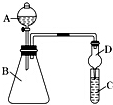 利用如图装置可验证酸的强弱规律.
利用如图装置可验证酸的强弱规律.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | B位于第二周期第ⅣA族 | |
| B. | A在同周期元素中原子半径最小 | |
| C. | A、B没有最高正化合价 | |
| D. | B、C所形成的化合物会引发温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操 作 | 实验现象 | 结 论 | |
| A | 某溶液中加入氯化钡、稀硝酸的 混合液 | 产生白色沉淀 | 该溶液中一定含有SO42-或SO32- |
| B | 取某溶液进行焰色反应 | 焰色呈黄色 | 该溶液一定是某钠盐的溶液 |
| C | 把湿润的碘化钾-淀粉试纸放入红棕色的气体中 | 试纸变蓝色 | 气体可能是NO2 |
| D | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液 | 溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  (立方烷) (立方烷) | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
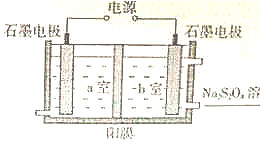
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2═C(CH3)2和CH3CH═CHCH3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH3CH2CH2COOH和CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
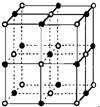 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com