
【题目】安全气囊做为车身被动安全性的辅助配置,日渐受到人们的重视,其设计原理为6NaN3+Fe2O3=3Na2O+2Fe+9N2↑,请回答下列问题:
(1)以上5种物质中属于电解质的是 ,属于盐类的是 。
(2)NH3分子的空间构型是 ,NH3分子可以作配体和铜离子形成四氨合铜离子[Cu(NH3)4]2+,请写出[Cu(NH3)4]2+的结构式 (注明配位键)。
(3)N和O的气态氢化物中,较稳定的是 (写化学式),氧的同族元素(包括O)的最简单氢化物中沸点最低的是 (写化学式)。
(4)写出一个与NaN3中N3-具有相似空间构型的等电子体(分子或离子) 。
【答案】(1)NaN3 、Fe2O3 、Na2O,NaN3;
(2)三角锥形,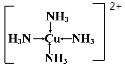 ;
;
(3)H2O,H2S;(4)CO2、CS2、CNO-、SCN-、N2O。
【解析】
试题分析:(1)电解质:在水溶液中或熔融状态下能够导电化合物,属于电解质为酸、碱、盐、金属氧化物等,因此属于电解质为NaN3、Fe2O3、Na2O,属于盐的是NaN3;(2)氨气分子中孤电子对数为(5-3×1)/2=1,价层电子数为4,则空间构型为三角锥,铜离子提供空轨道,氨气中N提供孤电子对,则结构式为: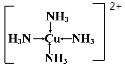 ;(3)同周期从左向右非金属性增强,非金属性越强,其氢化物越稳定,即H2O最稳定,H2O之间含有分子间氢键,沸点高,结构和组成相似,相对分子质量越大,分子间作用力越大,熔沸点越高,因此沸点最低的是H2S;(4)等电子体:原子总数相等、价电子总数相等,因此N3-的等电子体为CO2、CS2、CNO-、SCN-、N2O。
;(3)同周期从左向右非金属性增强,非金属性越强,其氢化物越稳定,即H2O最稳定,H2O之间含有分子间氢键,沸点高,结构和组成相似,相对分子质量越大,分子间作用力越大,熔沸点越高,因此沸点最低的是H2S;(4)等电子体:原子总数相等、价电子总数相等,因此N3-的等电子体为CO2、CS2、CNO-、SCN-、N2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. NA个氧气分子与NA个氖气分子的质量比是4∶5
B. 17gOH-与19gH3O+所含质子数相等
C. 标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等
D. 12g C和16g O所含的原子数不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备。工业上制备AlC13溶液用图示流程(已知A1C13易升华)。
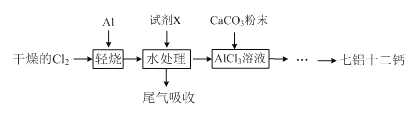
(1)轻烧后的气体用水处理前导气管为何要保温?
(2)用水处理添加的试剂X是 ,其目的是 。
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,其原因是 。用氨水沉淀、过滤后的滤液主要成分是 。
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, 。(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
补全实验步骤: 冰水洗涤,干燥,得到CaC12·2H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究氯气的性质并用Cl2制备HClO,设计如下实验方案,请回答下列问题:
实验一:性质探究
设计图3实验装置来制备并验证氯气的性质,部分夹持设计未画出。
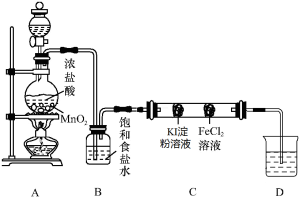
图3
(1)请写出装置A中制备氯气的反应化学方程式______________________;
(2)装置B的作用是______________________;
(3)双通管C中事先装有两个沾有相关试剂的棉球,实验现象为_____________;
实验二:制备HClO
(4)设计图4所示装置E代替图3中的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。


图4
①该方案反应后所得的溶液中HClO浓度比氯水中大的原因是_______________
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除CaCl2、HClO外,还含有__________
③该小组同学测得反应中碳酸钙质量减少a g,反应后从所得的100mL溶液中取用10mL与稀盐酸混合,连接F装置测得产生的气体体积为b L(已换算成标准状况),则原溶液中CaCl2的浓度为 mol·L-1(用含a、b的代数式表示,可不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1mol/L的氢氧化钠与0.06mol/L硫酸溶液等体积混合,该混合溶液的PH等于( )
A. 1.7 B. 2.0 C. 12.0 D. 12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀6.99 g。另一份溶液,先将Fe3+还原为Fe2+,再用0.1600 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。该聚合硫酸铁样品中a:b的比值为(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)。
A.1∶1 B.2∶1 C.3∶1 D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示实验室化学试剂浓硫酸标签上的部分内容。现需要490ml1.0moL·L-1H2SO4溶液。用该浓硫酸和蒸馏水配制,可供选用的仪器有:
①玻璃棒;②烧杯;③量筒。

请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有_______ _(写仪器名称)。
(2)经计算,所需浓硫酸的体积约为_________mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分_______49%(填“>” 、“<” 或“=”)。
(3)对所配制的稀硫酸进行测定,发现其浓度大于1mol·L-1,配制过程中下列各项操作可能引起该误差的原因是______________。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com