
| b |
| 8-a+b |
| 18g |
| Mc |
| 22.4L |
| 22.4L/mol |
 ;
;| C(NH 4 +)C(OH -) |
| C(NH 3?H 2O) |
| x 2 |
| 0.05-x |
| 0.002 |
| 2 |
| b |
| 8-a+b |
| 18g |
| Mc |
| 22.4L |
| 22.4L/mol |
 故答案为:钾;
故答案为:钾;  ;
;
 ;
;| C(NH 4 +)C(OH -) |
| C(NH 3?H 2O) |
| x 2 |
| 0.05-x |
| 0.002 |
| 2 |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| A、1 molCl2与足量Fe反应转移电子数一定为3NA |
| B、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C、1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D、标况下,11.2 L CCl4所含的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属氧化物都能与水反应生成碱 |
| B、非金属氧化物都能与水反应生成酸 |
| C、氧化铝既能与酸反应又能与氨水反应 |
| D、氧化铝坩埚不能用于熔融烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
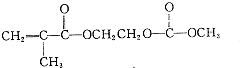
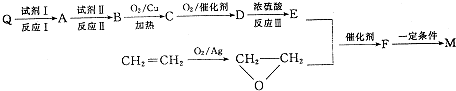
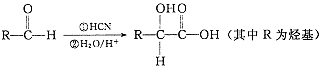
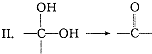
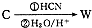 ,请写出符合下列条件的w的一种同分异构体的结构简式
,请写出符合下列条件的w的一种同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题:
如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题: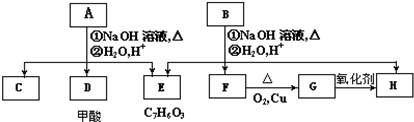
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com