
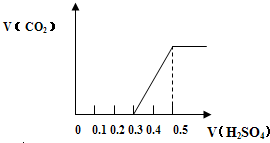
 分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令a=
分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令a=| m2 |
| m1 |
| 53 |
| 79 |
| 53 |
| 61 |
| 106 |
| 84+40 |
| 53 |
| 64 |
| 53 |
| 64 |
| ||
| ||
| ||
| 106 |
| 168 |
| 53 |
| 84 |
| 53 |
| 84 |
| 106 |
| 84+40 |
| 53 |
| 64 |
| 53 |
| 79 |
| 53 |
| 64 |
| 53 |
| 61 |
| 53 |
| 64 |
| 53 |
| 84 |
| 53 |
| 64 |
| 84×1.8g |
| 18 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、CH3COOH的电离度减少,PH减小 |
| B、平衡向生成CH3COOH移动,c(H+)减小 |
| C、CH3COOH电离度增大,c(H+)增大 |
| D、电离平衡向生成CH3COO-、H+方向移动,PH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、刚充入时反应速率v(正)增大,v(逆)增大 |
| B、达到新的平衡时,反应混合物中A、B的体积分数减小 |
| C、充入A、B、Q后,体系压强先增大,后逐渐减小 |
| D、若B为有色物质,达到新平衡后混合气颜色比原平衡浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+1s22s22p6 |
| B、F 1s22s22p5 |
| C、Cl-1s22s22p63s23p5 |
| D、Ar 1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝和氢氧化钠反应 |
| B、氯化铝溶液中滴加足量氢氧化钠溶液 |
| C、向NaAlO2溶液中通入过量的CO2气体 |
| D、氯化铝溶液中滴加足量的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com