
| A. | 5.6g | B. | 2.8 g | C. | 11.2g | D. | 无法计算 |
分析 盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl);用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2),据此结合m=nM计算得到的铁的质量.
解答 解:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.1L×2mol/L=0.1mol;
用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.1mol,质量为0.1mol×56g/mol=5.6g,
故选A.
点评 本题考查混合物的计算,难度中等,气体体积为干扰数据,利用元素守恒判断铁的物质的量是解题关键,注意守恒思想的运用.


科目:高中化学 来源: 题型:解答题
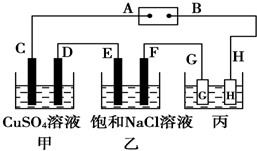 如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
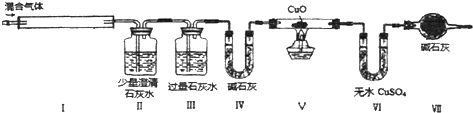
| A. | 混合气体中一定有NO2和CO | |
| B. | 混合气体中一定没有H2和NH3 | |
| C. | 混合气体中一定含有H2、NO、CO2、HCl四种气体 | |
| D. | 不能确定混合气体中是否有NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
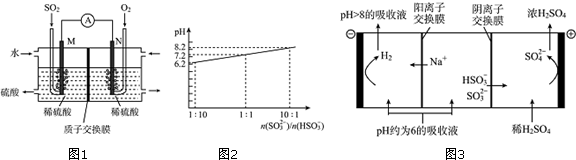
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②⑧①⑦④⑤⑥ | B. | ③②④①⑦⑧⑤⑥ | C. | ①③④⑦⑧⑤⑥② | D. | ②①③④⑦⑧⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com