
 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )| A. | Q是I- | |
| B. | Q是Br- | |
| C. | ab区间的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | b点时溶液中只有Cl- |
分析 离子还原性I->Fe2+>Br-,故首先发生反应:2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,据此判断.
解答 解:离子还原性I->Fe2+>Br-,故首先发生反应:2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,
A.若Q是I-,2I-+Cl2=I2+2Cl-,0.1molI-完全反应消耗0.05mol氯气,标准状况下为1.12L,此时碘离子为0,而图象中通入氯气为1.12L时,碘离子仍为0.1mol,与实际不符合,故A错误;
B.若Q是Br-,I-、Fe2+完全反应后,才发生2Br-+Cl2=Br2+2Cl-,0.1molI-完全反应消耗0.05mol氯气,0.1molFe2+完全反应消耗0.05mol氯气,故开始反应时氯气的体积为2.24L,图象中氯气的体积不符合,故B错误;
C.离子还原性I->Fe2+>Br-,故首先发生反应:2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,0.1molI-完全反应消耗0.05mol氯气,开始反应时氯气的体积为1.12L,0.1molFe2+完全反应消耗0.05mol氯气,此时氯气的体积为2.24L,所以ab区间的反应:2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D.根据C可知:b点时溶液中有Cl-,Fe3+、Br-,故D错误;
故选C.
点评 本题以图象形式考查氧化还原反应、有关离子反应计算等,题目难度中等,确定离子反应发生的先后顺序是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 甲苯与硝酸发生取代反应生成三硝基甲苯 | |
| B. | 甲苯能使热的酸性高锰酸钾溶液褪色 | |
| C. | 甲苯燃烧时产生带浓烈黑烟的火焰 | |
| D. | 1mol甲苯最多能与3mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃时,1mol SO2的体积一定大于22.4L | |
| B. | 常温常压下,1mol CO2与18 g H2O所含有的原子总数均为3 NA | |
| C. | 1mol/LNaCl溶液表示1L水中含有NaCl 58.5g | |
| D. | 标准状况下,11.2L NO与5.6 L O2形成的混合气体中含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H + NO3- Fe 2+ Na + | B. | Ag + NO3- Cl - K + | ||
| C. | K + Ba 2+ OH - SO42- | D. | Cu 2+ NH4+ Br - OH - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:青铜>铜 | B. | 热稳定性:NaHCO3>Na2CO3 | ||
| C. | 酸性:H2SiO3>H2CO3 | D. | 氧化性:Cl2>12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
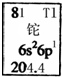
| A. | 铊元素的质量数是81 | B. | 铊原子的电子数为3 | ||
| C. | 铊原子的相对原子质量是204.4 | D. | 铊的金属性比铝的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| PCl5 | 2 | 105.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com