
【题目】Ⅰ、元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
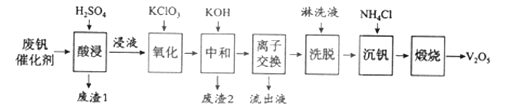
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________
(2)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:

在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为___________,___________。
【答案】蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液 Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O V2O5+2H+=2VO2++H2O 2NH4VO3![]() V2O5+H2O+2NH3↑ MnO4-+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+ 3Mn2++2MnO4-+2H2O=5MnO2↓+4H+
V2O5+H2O+2NH3↑ MnO4-+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+ 3Mn2++2MnO4-+2H2O=5MnO2↓+4H+
【解析】
I、(1)因为Cr3+与Al3+的化学性质相似,Al(OH)3有两性,可推测Cr(OH)3也应有两性,故Cr(OH)3应该能与碱反应生成Cr(OH)4-,再结合各粒子在溶液中的颜色和溶解性写出实验现象。
(2)NaHSO3作为还原剂,通常硫元素被氧化为+6价的Na2SO4,Cr2O72-被还原为Cr3+,+1价氢元素与-2价氧元素结合成稳定的H2O,由此写出离子方程式。
II(1)“酸浸”时V2O5转化为VO2+,钒元素的化合价都是+5价,应属于复分解反应,再根据电荷守恒和元素守恒写出其离子方程式。
(2)偏钒酸铵(NH4VO3)属于铵盐,铵盐受热一般易分解,再根据钒元素化合价分析确定该反应是否属于氧化还原反应,然后写出其化学方程式。
III、由题意知由“废钒催化剂”回收V2O5,而工业级氧化锌含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质,流程中必须除去铁元素、锰元素、镍元素。加稀硫酸后的浸出液中主要含ZnSO4、FeSO4、MnSO4、NiSO4。由流程图分析可知第②步应该是除去铁元素和锰元素,而Ni(II)不能被氧化,第③步是利用Zn置换出镍而除去镍元素。由此写出相应的离子方程式。
I、(1)因为Cr3+与Al3+的化学性质相似,因此向Cr2(SO4)3溶液逐滴加入NaOH溶液依次发生反应:Cr3++3OH-=Cr(OH)3↓,Cr(OH)3+OH-=Cr(OH)4-,所以可观察到的现象是:蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液。
(2)NaHSO3作为还原剂,通常硫元素被氧化为+6价的Na2SO4,Cr2O72-被还原为Cr3+,+1价氢元素与-2价氧元素结合成稳定的H2O,该反应的离子方程式为Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O。
II(1)“酸浸”时V2O5转化为VO2+,钒元素的化合价没有变化,应属于复分解反应,所以其离子方程式为V2O5+2H+=2VO2++H2O。
(2)偏钒酸铵(NH4VO3)属于铵盐,铵盐受热一般分解为氨气和水,根据目标产品V2O5看,钒元素化合价没有变化,故该分解反应不属于氧化还原反应,“煅烧”中发生反应的化学方程式为2NH4VO3![]() V2O5+H2O+2NH3↑。
V2O5+H2O+2NH3↑。
III、因为工业级氧化锌含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质,加稀硫酸后的浸出液中主要含ZnSO4、FeSO4、MnSO4、NiSO4。由流程图分析可知第②步应该是除去铁元素和锰元素。Fe2+和Mn2+都有较强的还原性,KMnO4是强氧化剂被还原为MnO2,溶液pH约为5时铁元素主要以Fe(OH)3形式存在。由此得到反应②中发生反应的离子方程式为MnO4-+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+,3Mn2++2MnO4-+2H2O=5MnO2↓+4H+。


科目:高中化学 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是

A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t ℃时,Ag2CrO4的Ksp为1×10-8
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t ℃时,Y点和Z点时Ag2CrO4的Ksp相等
D. t ℃时,将0.1 mol·L-1 AgNO3滴入20 mL 0.1 mol·L-1 KCl和0.1 mol·L-1 K2CrO4的溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天技术测得三氧化二碳(C2O3)是金星大气层的成份之一,下列关于C2O3的说法中错误的是
A.C2O3与CO2都是碳的氧化物B.C2O3与CO2都是碳酸的酸酐
C.C2O3与CO都具有还原性D.C2O3与C的燃烧产物都是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用硫酸银与硫黄培烧制备氧化铝,再电解氧化铝,发生反应如下:反应Ⅰ:2A12(SO4)3+3S![]() 2Al2O3+9SO2↑
2Al2O3+9SO2↑
反应Ⅱ:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
下列说法正确的是
A. 反应Ⅰ中S 单质是氧化剂
B. 反应Ⅱ中铝元素被氧化
C. 当生成5.4gAl时,反应Ⅰ和Ⅱ共转移1.2mole-
D. 反应Ⅰ中氧化产物与还原产物物质的量之比为2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+OH─(aq)=H2O(l) △H=-57.3kJ ·mol-1。按照图1所示装置进行实验。
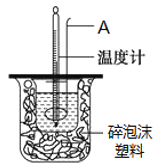
(1)仪器A的名称是________。
(2)碎泡沫塑料的作用是________。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L-1 CH3COOH溶液、50mL 0.55 mol·L-1 NaOH溶液进行实验,测得的中和热△H________-57. 3 kJ ·mol-1(填“>”“=”或“<”),原因是 ________。
Ⅱ.中和滴定
(1)用_______量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为________ (保留两位有效数字)。滴定达到终点的标志是________。
(2)若某次滴定结束时,滴定管液面如图2所示,则终点读数为________mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
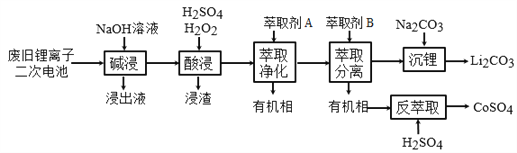
回答下列问题:
(1)“碱浸”的目的是_______。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________
浸渣中含有的主要成分是________________。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。
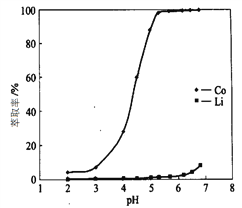
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:
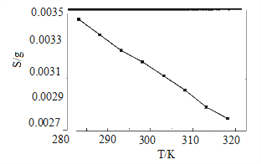
①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇。已知氢气、甲醇燃烧的热化学方程式如下:
①2H2(g)+O2(g)=2H2O(l) △H=- 283.0kJ/mol;
②2CH3OH (1)+3O2=2CO2(g)+4H2O(1) △H=- 726.0kJ/mol。
(1)写出二氧化碳与氢气合成甲醇液体的热化学方程式____。
(2)已知:CO2 (g)+3H2 (g)=CH3OH (g)+H2O(g) △H=- 49.0kJ/mol,将6molCO2和8mol H2充入4L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线),图中数据a(l,6)表示在1min时H2的物质的量是6mol。

①b点正反应速率____(填“大于”“等于”或“小于”)逆反应速率。此温度下该反应的平衡常数为____。
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅱ对应的实验条件改变是____,体积不变再充入3 mol CO2和4mol H2,H2O(g)的体积分数____(填“增大”“不变”或“减小”)
Ⅱ.粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+<Ni2+<Cu2+)
(1)铅蓄电池的负极电极反应式为 ___。
(2)粗镍提纯的阴极反应式为 ___。电解结束后,阳极附近产生的沉淀物的主要成分为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
(1)当有34gNH3参加反应时,被氧化的物质的质量为_____ g,生成的还原产物的质量为_______g。
(2)在反应:K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O中,用氧化还原反应的知识____是氧化剂,_____是还原剂,用“双线桥法”表示反应中电子转移的方向和数目:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com