
| A. | 未知浓度酸液用滴定管量取,滴定管用蒸馏水洗涤后,没用待测酸液润洗 | |
| B. | 装待测液的锥形瓶用蒸馏水洗涤后,没用待测液冲洗 | |
| C. | 量取酸液的体积时,开始仰视凹液面,取液结束时俯视凹液面 | |
| D. | 滴定开始滴定管尖端有气泡,到达终点时尖端无气泡 |
分析 A.未用待测液洗酸式滴定管,导致消耗标准液体积减小,测定浓度偏低;
B.锥形瓶不能润洗,该操作方法合理;
C.量取酸液的体积时,开始仰视凹液面,读出的溶液体积比实际体积偏大,取液结束时俯视凹液面,导致量取的待测液溶液体积偏大;
D.滴定开始滴定管尖端有气泡,到达终点时尖端无气泡,导致读出的标准液体积偏大,测定结果偏高.
解答 解:A.未知浓度酸液用滴定管量取,滴定管用蒸馏水洗涤后,没用待测酸液润洗,导致待测液浓度偏小,滴定过程中消耗标准液体积偏小,测定结果偏低,故A正确;
B.装待测液的锥形瓶用蒸馏水洗涤后,不能用待测液润洗,对待测液总物质的量无影响,则不影响测定结果,故B错误;
C.量取酸液的体积时,开始仰视凹液面,取液结束时俯视凹液面,该操作方法量取的酸溶液体积偏大,滴定时消耗的标准液体积偏大,测定结果偏高,故C错误;
D.滴定开始滴定管尖端有气泡,滴定终点时尖端无气泡,滴定结束时读出的标准液体积偏大,测定结果会偏高,故D错误;
故选A.
点评 本题考查了中和滴定操作方法及误差分析,题目难度不大,明确中和滴定操作方法为解答关键,C为易错点,注意该操作方法导致量取的待测液体积偏大,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
科学家己发现一种新型气态氢分子H3,在同温、同压下,等体积的H3和H2具有相同的
A.原子数 B.分子数 C.密度 D.质子数
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测NaOH溶液的体积/mL | 滴定完成时,消耗盐酸的体积/mL |
| 1 | 20.00 | 22.40 |
| 2 | 20.00 | 22.42 |
| 3 | 20.00 | 22.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.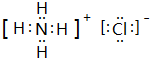 ,A2C2的电子式为
,A2C2的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
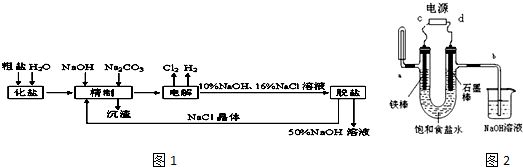
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
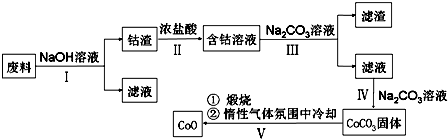
| A. | 第Ⅰ步反应后得到的滤液主要是含铝溶液 | |
| B. | 第Ⅱ步中盐酸表现出酸性、还原性,且必须过量 | |
| C. | 第Ⅲ步中Na2CO3主要作用是使Fe3+沉淀,滤渣主要为Fe(OH)3 | |
| D. | 第Ⅳ步操作为过滤,第Ⅴ步煅烧后,也可以在一氧化碳气体氛围中冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
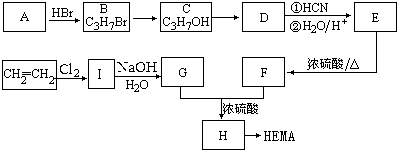
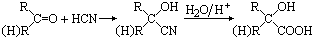
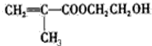 甲基丙烯酸羟乙酯
甲基丙烯酸羟乙酯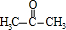 +2H2O.
+2H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com