
| A£® | HOCH2CHOÄÜ·¢ÉśČ”“ś·“Ó¦”¢¼Ó³É·“Ó¦”¢Ńõ»Æ·“Ó¦ | |
| B£® | ŅŅ“¼Č©ĢĒŹĒŅ»ÖÖÓŠ»śĪļ£¬ÄÜČ¼ÉÕ£¬æÉČÜÓŚĖ® | |
| C£® | HOCH2CHOÓėŅŅĖį”¢¼×Ėį¼×õ„»„ĪŖĶ¬·ÖŅģ¹¹Ģå | |
| D£® | ŅŅ“¼Č©ĢĒÓėĘĻĢŃĢĒ¾ßÓŠĻąĖʵĻÆѧŠŌÖŹ£¬ĒŅ»„ĪŖĶ¬ĻµĪļ |
·ÖĪö HOCH2CHOÖŠŗ¬-OH”¢-CHO£¬½įŗĻ“¼”¢Č©µÄŠŌÖŹĄ“½ā“š£®
½ā“š ½ā£ŗA£®ŗ¬-OHæÉ·¢ÉśČ”“ś”¢Ńõ»Æ·“Ó¦£¬ŗ¬-CHOæÉ·¢Éś¼Ó³É”¢Ńõ»Æ·“Ó¦£¬¹ŹAÕżČ·£»
B£®ŗ¬C”¢H”¢OŌŖĖŲ£¬ÄÜČ¼ÉÕ£¬ŗ¬-OHæÉČÜÓŚĖ®£¬¹ŹBÕżČ·£»
C£®HOCH2CHOÓėŅŅĖį”¢¼×Ėį¼×õ„µÄ·Ö×ÓŹ½ĻąĶ¬£¬½į¹¹²»Ķ¬£¬»„ĪŖĶ¬·ÖŅģ¹¹Ģ壬¹ŹCÕżČ·£»
D£®ŅŅ“¼Č©ĢĒÓėĘĻĢŃĢĒ¾ßÓŠĻąĖʵĻÆѧŠŌÖŹ£¬µ«-OHµÄŹżÄæ²»Ķ¬£¬¶žÕß²»»„ĪŖĶ¬ĻµĪļ£¬¹ŹD“ķĪó£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļµÄ½į¹¹ÓėŠŌÖŹ£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕ¹ŁÄÜĶÅÓėŠŌÖŹµÄ¹ŲĻµ”¢ÓŠ»ś·“Ó¦ĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅāŃ”ĻīDĪŖŅדķµć£¬ĢāÄæÄŃ¶Č²»“ó£®


 Č«ÓŵćĮ·µ„ŌŖ¼Ę»®ĻµĮŠ“š°ø
Č«ÓŵćĮ·µ„ŌŖ¼Ę»®ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 4ÖÖ | B£® | 6ÖÖ | C£® | 7ÖÖ | D£® | 9ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±£“ęNaClOČÜŅŗŹ±¼ÓČėÉŁĮæNaOHæÉŅŌŅÖÖĘĖ®½ā | |
| B£® | pH£¼4Ź±£¬ĘšĘÆ°××÷ÓƵÄCl2ŹĒHClO·Ö½ā²śÉśµÄ | |
| C£® | ĖępH½µµĶ£¬ČÜŅŗÖŠHClOŗĶCl2Ōö¶ą£¬ĖłŅŌĘÆ°×ĖŁĀŹ¼Óæģ | |
| D£® | ÓĆNaClOČÜŅŗĘÆ°×É«ĖŲŹ±£¬²»Ķ¬Ģõ¼žĻĀÓɲ»Ķ¬³É·ÖĘšµ½ĘÆ°××÷ÓĆ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ļ”“×ĖįÖŠ¼ÓČėÉŁĮæ“×ĖįÄĘÄÜŌö“ó“×ĖįµÄµēĄė³Ģ¶Č | |
| B£® | 25”ꏱ£¬µČĢå»żµČÅØ¶ČµÄĻõĖįÓė°±Ė®»ģŗĻŗó£¬ČÜŅŗpH=7 | |
| C£® | 50”ꏱ£¬NH4ClŗĶHClµÄ»ģŗĻŅŗÖŠ£ŗc£ØNH4+£©+c£ØH+£©=c£ØOH-£©+c£ØCl-£© | |
| D£® | 0.1molAgClŗĶ0.1molAgI»ģŗĻŗó¼ÓČė1LĖ®ÖŠ£¬ĖłµĆČÜŅŗÖŠc£ØCl-£©=c£ØI-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
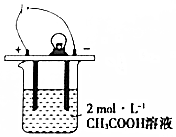 ČēĶ¼ĖłŹ¾£¬ÉÕ±ÖŠµÄČÜŅŗĪŖ2mol•L-1CH3COOHČÜŅŗ£¬½ÓĶØÖ±Į÷µēŌ“£¬·Ö±šĻņÉÕ±ÖŠ¼ÓČėĻĀĮŠĪļÖŹ£Ø±£³Ö·“Ó¦ĪĀ¶Č²»±ä£©£¬µĘÅŻ±ä°µµÄŹĒ£Ø””””£©
ČēĶ¼ĖłŹ¾£¬ÉÕ±ÖŠµÄČÜŅŗĪŖ2mol•L-1CH3COOHČÜŅŗ£¬½ÓĶØÖ±Į÷µēŌ“£¬·Ö±šĻņÉÕ±ÖŠ¼ÓČėĻĀĮŠĪļÖŹ£Ø±£³Ö·“Ó¦ĪĀ¶Č²»±ä£©£¬µĘÅŻ±ä°µµÄŹĒ£Ø””””£©| A£® | ¼ÓČė¹ĢĢåNaOH | B£® | ¼ÓĖ®Ļ”ŹĶ | C£® | ¼ÓČė½šŹōNa | D£® | ĶØČėHC1ĘųĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1mol/LµÄNH4ClČÜŅŗ£ŗc£ØCl-£©£¾c£ØNH4+£©£¾c£ØOH-£©£¾c£ØH+£© | |
| B£® | 0.1mol/LµÄCH3COONa£ŗc£ØCH3COOH£©£¾c£ØH+£©£¾c£ØCH3COO-£©£¾c£ØOH-£© | |
| C£® | ijFeCl3ČÜŅŗpH=4£ŗc£ØCl-£©£¾c£ØH+£©£¾c£ØFe3+£©£¾c£ØOH-£© | |
| D£® | ijČõĖįµÄĖįŹ½ŃĪNaHAČÜŅŗÖŠŅ»¶ØÓŠ£ŗc£ØOH-£©+2c£ØA2-£©ØTc£ØH+£©+c£ØNa+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
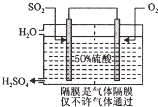 ĮņĖįŹĒ¹¤ŅµÉś²śÖŠ×īĪŖÖŲŅŖµÄ²śĘ·Ö®Ņ»£¬ŌŚ»Æѧ¹¤ŅµµÄŗܶąĮģÓņ¶¼ŅŖÓƵ½ÅØĮņĖį£®
ĮņĖįŹĒ¹¤ŅµÉś²śÖŠ×īĪŖÖŲŅŖµÄ²śĘ·Ö®Ņ»£¬ŌŚ»Æѧ¹¤ŅµµÄŗܶąĮģÓņ¶¼ŅŖÓƵ½ÅØĮņĖį£®| ”””””””””””””””””””””” Ń¹Ēæ SO2×Ŗ»ÆĀŹ ĪĀ¶Č”””””””””” | 1øö“óĘųŃ¹ | 5øö“óĘųŃ¹ | 10øö“óĘųŃ¹ | 15øö“óĘųŃ¹ |
| ””400”ę | ””0.9961 | ””0.9972 | ””0.9984 | ””0.9988 |
| ””500”ę | ””0.9675 | ””0.9767 | ””0.9852 | ””0.9894 |
| ””600”ę | ””0.8520 | ””0.8897 | ””0.9276 | ””0.9468 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
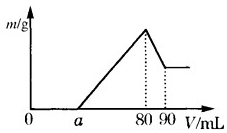 £Ø1£©°ŃŅ»¶ØÖŹĮæµÄĆ¾”¢ĀĮ»ģŗĻĪļĶ¶Čėµ½ 2mol•L-1 µÄŃĪĖįÖŠ£¬“ż½šŹōĶźČ«Čܽāŗó£¬ĻņČÜŅŗÖŠ¼ÓČė 2mol•L-1 µÄĒāŃõ»ÆÄĘČÜŅŗ£¬Éś³É³ĮµķµÄÖŹĮæÓė¼ÓČėĒāŃõ»ÆÄĘČÜŅŗµÄĢå»ż¹ŲĻµČēĶ¼ĖłŹ¾£®Ōņ£ŗ
£Ø1£©°ŃŅ»¶ØÖŹĮæµÄĆ¾”¢ĀĮ»ģŗĻĪļĶ¶Čėµ½ 2mol•L-1 µÄŃĪĖįÖŠ£¬“ż½šŹōĶźČ«Čܽāŗó£¬ĻņČÜŅŗÖŠ¼ÓČė 2mol•L-1 µÄĒāŃõ»ÆÄĘČÜŅŗ£¬Éś³É³ĮµķµÄÖŹĮæÓė¼ÓČėĒāŃõ»ÆÄĘČÜŅŗµÄĢå»ż¹ŲĻµČēĶ¼ĖłŹ¾£®Ōņ£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com