
【题目】为了将混有Na2SO4、NH4HCO3的NaCl提纯。某学习小组设计了如图所示的方案:
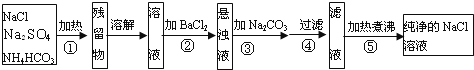
(1)操作①盛放药品的仪器名称是___________,发生反应的化学反应方程式为__________________。
(2)进行操作②后,如何判断杂质是否除尽?_______________________________________________。
(3)操作③的目的是_____________________。
(4)请你评价该设计方案设计是否严密?若不严密,请说明理由,并提出改进方案_______________。
【答案】坩埚 NH4HCO3![]() NH3 ↑+ CO2↑+ H2O 取上层清液,滴加BaCl2溶液,无沉淀生成,说明杂质已除净 除去过量的Ba2+ 不严密,混有杂质Na2CO3,应加入适量盐酸,再加热煮沸
NH3 ↑+ CO2↑+ H2O 取上层清液,滴加BaCl2溶液,无沉淀生成,说明杂质已除净 除去过量的Ba2+ 不严密,混有杂质Na2CO3,应加入适量盐酸,再加热煮沸
【解析】
混有硫酸钠、碳酸氢铵的氯化钠固体,由流程可知,①中在生加热条件下碳酸氢铵发生分解反应变为气体逸出,分解后的固体溶于水,与氯化钡反应可除去硫酸根离子,再利用碳酸钠除去过量的钡离子,过滤后的滤液中含NaCl、碳酸钠,再加过量的盐酸就可除去碳酸钠,反应后溶质为NaCl、HCl,通过蒸发就能得到纯净的NaCl,以此来解答。
(1)将固体混合物加热是在坩埚中进行的;碳酸氢铵不稳定,加热分解,反应化学方程式是: NH4HCO3![]() NH3 ↑+ CO2↑+ H2O;
NH3 ↑+ CO2↑+ H2O;
(2)向Na2SO4、NaCl混合溶液中加入过量氯化钡溶液,发生反应:Ba2++SO42-=BaSO4↓;若硫酸根离子被除尽,那么再加入硝酸钡溶液时,就不会产生沉淀。通过取过滤后的上层清液,向其中滴加BaCl2溶液,若无沉淀生成,说明杂质已除净;
(3)操作②加入过量的氯化钡溶液可将SO42-除尽,但又引入了杂质离子Ba2+,操作③加入碳酸钠溶液时,碳酸钠就可与过量的氯化钡发生沉淀反应生成碳酸钡沉淀,从而可达到除去过量杂质Ba2+的目的;
(4)加入过量的碳酸钠溶液,可以除去溶液中过量的Ba2+,但同时又引入了新的杂质Na2CO3。该物质加热不反应,不能去除,因此此设计方案不严密,正确操作方法为在操作③加过量的Na2CO3溶液反应后过滤除去BaCO3沉淀,在操作④之后再向滤液中加过量盐酸,盐酸与碳酸钠反应,除去Na2CO3,最后通过加热煮沸除去HCl,就可得到纯净的NaCl溶液。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】将5.10g镁铝合金加入120mL4.0mol·L-1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是
A. 合金完全溶解后产生的H2的物质的量为0.24mol
B. 合金中的镁与铝的物质的量之比小于1
C. 若向溶液X中加入270mL2.0mol·L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D. 若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由石油分馏得到的轻质油可在Pt催化下脱氢环化,逐步转化为芳香烃。以链烃A为原料合成两种高分子材料的路线如下图所示:

已知以下信息:
①B的核磁共振氢谱中只有1组峰,G为一氯代烃;
② R-X+Rˊ-X ![]() R- Rˊ(X代表卤素原子,R、Rˊ代表烃基)。
R- Rˊ(X代表卤素原子,R、Rˊ代表烃基)。
请回答以下问题:
(1) B的化学名称为______________________。
(2)由G生成H的化学方程式为_____________________。
(3) J的结构简式为_________________。
(4)由F合成丁苯橡胶的化学方程式为________________________。
(5)Ⅰ的同分异构体中能同时满足下列条件的共有____________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体;
②既能发生银镜反应,又能发生水解反应。
其中核磁共振氢谱中有4组峰,且峰面积之比为6:2:1:1的是_________________(写出其中一种的结构简式)。
(6)参照上述合成路线,以2-甲基己烷和一氯甲烷为原料(无机试剂任选),设计制备化合物E的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu
B. 用石墨电极电解CuCl2溶液:2Cu2++2H2O![]() 2Cu↓+4H++O2↑
2Cu↓+4H++O2↑
C. 向Na2S2O3溶液中滴加等物质的量的稀硫酸:S2O32-+2H+=S↓+SO42-+H2O
D. 向Mg(OH)2沉淀中滴加过量氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 用过量石灰乳吸收工业尾气中的SO2: Ca2++2OH-+SO2=CaSO3 ↓+ H2O
B. 用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2=2Mn2++5O2 ↑+8H2O
C. 用铜做电极电解NaCl溶液:2C1—+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
D. 将 Fe2O3加入到 HI 溶液中:Fe2O3+ 6H+=2Fe3+ +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,用离子方程式解释其目的__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,请你代表乙组发表改进方案_____________。
(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
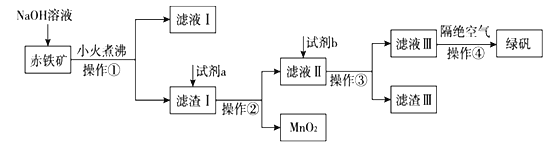
(4)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________________________。
(5)向滤渣Ⅰ中加入过量的试剂a为___________,加入过量试剂b后所得滤渣Ⅲ的主要成分为______。
(6)操作③需要的玻璃仪器主要包括_______________。
(7)操作④需要隔绝空气的主要原因可能是什么?______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置是化学实验中的常用装置,它有多种用途,以下各项用途和操作都正确的是
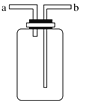
A. 洗气或干燥装置:瓶内放一定体积溶液,由a管口进气
B. 用于收集不溶于水的气体:瓶内充满水,由b管口进气
C. H2S和SO2反应的装置:由a管口通入H2S,b管口通入SO2
D. 提供少量CO:瓶内充满CO,b管口接自来水龙头
查看答案和解析>>
科目:高中化学 来源: 题型:
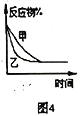
【题目】下列图示与对应的叙述相符的是( )
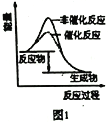


A. 图1表示分别在有、无催化剂的情况下某吸热反应过程中的能量变化
B. 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C. 图3表示mg冰醋酸加水稀释过程中溶液导电能力的变化,其中醋酸的电离度c>b>a
D. 图4表压强对合成氨反应的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V (已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
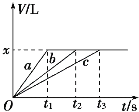
A. x=2.24 B. 曲线b为Mg与盐酸反应的图象
C. 反应时,Na、Mg、Al均过量 D. 钠的物质的量为0.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com