
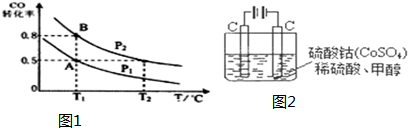
分析 (1)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(2)A、B温度相同,则化学平衡常数也相同,可利用A点时计算出化学平衡常数,计算得出B的体积;
(3)根据化学平衡状态的判断依据进行判断;
(4)利用盖斯定律计算得出热化学方程式;
(5)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
解答 解:(1)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,K=$\frac{c(CH{\;}_{3}OH)}{c{\;}^{2}(H{\;}_{2})•c(CO)}$,故答案为:K=$\frac{c(CH{\;}_{3}OH)}{c{\;}^{2}(H{\;}_{2})•c(CO)}$;
(2)密闭容器中充入10mol CO和20mol H2,达到平衡状态B时,CO转化率为0.8,此时各物质的物质的量为CO为2mol,H2为4mol,CH3OH为8mol,气体的物质的量为14mol,容器体积为4L;若反应开始时仍充入10mol CO 和20mol H2,达到平衡状态A时,CO转化率为0.5,此时各物质的物质的量为CO为5mol,H2为10mol,CH3OH为5mol,气体的物质的量为20mol;由于A、B温度相同,化学平衡常数相同,设A点气体体积为V,则有$\frac{\frac{8}{4}}{\frac{2}{4}×(\frac{4}{4}){\;}^{2}}$=$\frac{\frac{5}{V}}{\frac{5}{V}×(\frac{10}{V})^{2}}$,V=20L,故答案为:20;
(3)A、CO的含量保持不变,各组分的物质的量,总物质的量不变,达到化学平衡状态,故A正确;
B、容器中CH3OH浓度与CO浓度相等,是一个比较特殊的情况,此时可能达到平衡状态,也可能未达到平衡状态,故B错误;
C、2V正(CH3OH)=V正(H2),都是指正反应方向,不能判断达到化学平衡状态,故C错误;
D、M平均=$\frac{m{\;}_{总}}{n{\;}_{总}}$,气体总质量不变,反应前后计量数不同,即反应前后气体n总不同,所以当M平均不变时,达到了化学平衡状态,故D正确;
故选:AD;
(4)将CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1与CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ•mol-1,相加可得到CO2和H2制取甲醇的热化学方程式CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5 kJ•mol-1,故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5 kJ•mol-1;
(5)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
点评 本题考查了盖斯定律的应用、化学平衡常数的应用、电解池原理分析和电极反应书写方法,化学平衡状态的特征及判断、化学平衡图象等知识、题目难度较大,注意认真分析.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
| 编号 | Na2S04溶液 | AgN03溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积/滴 | 浓度/(mol•L-1) | ||
| ① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
| 编号 | AgNO3浓度/(mol•L-1) | 稀释后Ag+浓度/(mol•L-1) | 混合液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.0l | 0.12 |
| ④ | 0.001 |
| 编号 | AgNO3溶液 浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+NH3•H2O+2BaSO4↓ | |
| B. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL | B. | 72mL | C. | 78mL | D. | 100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体质量不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内混合气体的密度不随时间变化 | |
| D. | 单位时间内消耗0.1 mol X的同时生成0.2 mol Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com